| Issue |
Med Sci (Paris)
Volume 18, Number 6-7, Juin–Juillet 2002
|
|
|---|---|---|
| Page(s) | 780 - 783 | |
| Section | Forum : Hypothèses Et Débats | |
| DOI | https://doi.org/10.1051/medsci/20021867780 | |
| Published online | 15 June 2002 | |
La protéine découplante du tissu adipeux brun (UCP1) : la fin des dogmes
Uncoupling protein of braun adipose tissu: the end of a dogma
UMR Cnrs 5018, IFR31, CHU Rangueil, 1, avenue Jean Poulhès, 31045 Toulouse Cedex, France
La protéine découplante du tissu adipeux brun a été la première protéine identifiée capable de découpler le fonctionnement de la chaîne respiratoire de la synthèse d’ATP. Elle était considérée comme spécifique et strictement associée à la thermogenèse. La découverte de son expression dans les couches musculaires lisses longitudinales des tractus reproducteur et gastro-intestinal de la souris pourrait expliquer les différences de comportement contractiles entre les couches circulaire et longitudinale. Si cette découverte était confirmée chez l’homme, les implications physiopathologiques seraient particulièrement nombreuses.
Abstract
The uncoupling protein of brown fat was the first protein described to uncouple respiratory chain function from ATP synthesis. It was considered as unique and strictly associated to thermogenesis. The recent discovery of its expression in longitudinal smooth muscle cells of sexual and gastrointestinal tracts suggests its role in relaxation of longitudinal compared to circular smooth muscle layers. Such result opens numerous pathophysiological perspectives, which need to be confirmed in humans.
© 2002 médecine/sciences - Inserm / SRMS
L’implication majeure de la mitochondrie dans le métabolisme énergétique est due aux nombreuses voies métaboliques localisées dans cet organite et à sa capacité de convertir l’énergie en molécules d’ATP. Les oxydations phosphorylantes sont le siège de cette conversion dont le principe de fonctionnement, établi par le Pr Peter D. Mitchell sous le nom de théorie chimio-osmotique, a valu à son auteur le prix Nobel en 1978. Selon cette théorie, démontrée depuis, le transfert des électrons du NADH vers I’oxygène, via les différents complexes de la chaîne respiratoire, est associé à l’expulsion de protons de la matrice mitochondriale vers l’espace intermembranaire. Ce flux de protons crée un gradient électrochimique de part et d’autre de la membrane interne. La dissipation de ce gradient, par l’ATP synthase et en présence d’ADP, permettra la synthèse d’ATP. Celle-ci est donc très dépendante, via la production du gradient de protons, du fonctionnement de la chaîne respiratoire : la respiration de la mitochondrie est dite couplée (Figure 1A). L’établissement de ce gradient nécessite que la membrane interne soit imperméable aux protons. C’est le cas dans la majorité des situations, à une exception près dans le règne animal, celle de la mitochondrie des adipocytes bruns. Ces adipocytes, contrairement à leurs cousins, les adipocytes blancs, sont spécialisés dans la production de chaleur et participent à la thermogenèse hors de tout frisson (par opposition à la production de chaleur associée au frisson musculaire) et à celle qu’induit l’alimentation. Cette capacité thermogénique est due à une perméabilité importante de la membrane interne aux protons, qui permet de dissiper le gradient électrochimique indépendamment de l’ATP synthase. Cela a pour conséquence de dissocier le fonctionnement de la chaîne respiratoire et la synthèse d’ATP, l’énergie étant alors libérée sous forme de chaleur : la respiration de la mitochondrie est dite découplée. Ce mécanisme a été mis à jour par Nicholls et al. [1] et suivi, peu après, par l’identification moléculaire d’une protéine, membre des transporteurs anioniques mitochondriaux, la protéine découplante, et par le clonage de son gène [2]. Cette protéine, insérée dans la membrane interne, agirait comme un canal à protons et serait responsable de la perméabilité accrue de la membrane interne aux protons (Figure 1B). Ainsi, jusqu’en 1997, la protéine découplante (ou UCP) du tissu adipeux brun était caractérisée par trois propriétés fondamentales élevées au rang de dogmes : elle était unique, spécifique des adipocytes bruns, et sa fonction était strictement liée à la thermogenèse. Ce dernier point avait été conforté par le phénotype des souris dont le gène codant pour l’UCP avait été invalidé [3]. En effet, lorsqu’elles sont exposées au froid (à 4°C), ces souris ne peuvent plus maintenir leur température corporelle et meurent.
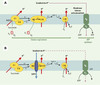 |
Figure 1. Schéma de fonctionnement d’une mitochondrie en l’absence ou en présence d’UCP1. A. Dans la majorité des mitochondries, le transfert des électrons d’un complexe à l’autre (C I, C II, C III, C IV) de la chaîne respiratoire est associé à l’expulsion de protons dans l’espace intermembranaire. L’accepteur final de ces électrons est l’oxygène qui donnera alors des molécules d’eau. La membrane interne étant très peu perméable aux protons, ceux-ci s’accumulent et engendrent un gradient électrochimique qui sera utilisé par l’ATP synthase pour transformer cette énergie en molécule d’ATP : la consommation d’oxygène (autrement dit la respiration) est couplée à la production d’ATP. Au cours du transfert d’électrons, il y aura obligatoirement la production d’anions superoxyde (O2-) au niveau des complexes I et surtout III. L’intensité de cette production est fonction des contraintes exercées sur ces complexes [15]. B. Dans les cellules qui expriment UCP1, cette protéine s’insère sous forme dimérique dans la membrane interne et agit comme un canal à protons qui dissipe le gradient électrochimique dû au fonctionnement de la chaîne respiratoire sans permettre la synthèse d’ATP : l’énergie sera libérée sous forme de chaleur, la respiration est découplée de la synthèse d’ATP. L’activité d’UCP1 est contrôlée de manière importante par le coenzyme Q, ce qui pourrait suggérer que dans les mitochondries qui contiennent ce type de protéines, celles-ci font partie intégrante de la chaîne respiratoire et permettraient une régulation fine et complexe du fonctionnement de celle-ci [16]. UQ : ubiquinone ; cyt-c : cytochrome c. |
Le fonctionnement intime de cette protéine est encore très débattu, en dépit des nombreuses études qui y ont été consacrées ainsi qu’au contrôle de l’expression de son gène [2]. D’un point de vue physiopathologique, son rôle est difficile à cerner compte tenu de notre méconnaissance de l’importance physiologique de la thermogenèse associée aux adipocytes bruns chez l’homme adulte. Cependant, en 1997, Fleury et al. clonaient, par homologie de séquence avec l’UCP du tissu adipeux brun, un ADNc correspondant à une protéine apparentée [4]. Cette protéine, lorsqu’elle était surexprimée dans des levures, entraînait le découplage de la respiration des mitochondries isolées, d’où le nom de UCP2, pour uncoupling protein 2, qui lui a été attribué. Elle est exprimée dans certains types cellulaires dont les monocytes/macrophages. L’UCP « historique » des adipocytes bruns n’était plus « unique » et restait tête de liste ou UCP1. Le premier dogme tombait. D’autres protéines découplantes avec d’autres profils d’expression allaient être rapidement identifiées, chez les animaux aussi bien que chez les plantes [5, 7] (→). Ces découvertes et l’appellation protéines découplantes ont eu deux conséquences. Tout d’abord, par un « réflexe UCP », l’expression de ce type de protéines dans de nombreux tissus adultes a suscité de très nombreuses études et espérances concernant la dissipation d’énergie par ces protéines sous forme de chaleur. Pourtant, il y avait une certaine contradiction entre l’augmentation de l’expression d’UCP2 en situation de jeûne (situation physiologique où l’organisme tend à épargner l’énergie) et l’implication de cette protéine dans la dissipation d’énergie [8]. Enfin, ces découvertes ont détourné l’attention de la communauté scientifique de l’UCP1.
(→) m/s 1998, n°8-9, p.889
Rapidement après la découverte d’UCP2, nous avons proposé que les UCP puissent être impliquées dans le contrôle de la production mitochondriale d’espèces actives de l’oxygène [9]. La production d’anions superoxydes par la mitochondrie est obligatoirement associée au transfert des électrons au niveau des complexes I et surtout III (cycle des quinones) de la chaîne respiratoire. Plus les éléments de ces complexes sont réduits, plus la production d’anions superoxydes est favorisée. Les UCP, par leur activité de découplage qui dissipe rapidement le gradient de protons, faciliteraient le transfert d’électrons et diminueraient le niveau de réduction du complexe I et des quinones. Cela fut confirmé par l’analyse du phénotype des animaux dont le gène codant pour UCP3 était invalidé [10]. L’étude du phénotype des souris UCP2−/− démontrait, quant à elle, l’implication de cette protéine dans le contrôle de la sécrétion d’insuline, mais aussi un lien étroit entre l’expression de l’UCP2 et la production de radicaux libres par le macrophage [11, 12] (→). En effet, après stimulation par des lipopolysaccharides (LPS), les macrophages péritonéaux UCP2−/− produisent beaucoup plus d’espèces actives de l’oxygène que des macrophages de souris sauvages stimulés dans les mêmes conditions. Si l’analyse de ce phénotype n’est pas aussi évidente qu’il n’y paraît, elle confirme cependant l’absence de lien direct entre UCP2 et thermogenèse. Ne subsistait plus que le deuxième dogme : UCP1 est spécifique des adipocytes bruns et liée à la thermogenèse.
(→) m/s 2001, n°1, p. 107
En fait, le rôle du tissu adipeux brun avait été démontré dans deux modèles génétiques : les animaux UCP1−/− cités précédemment, et des souris transgéniques exprimant une sous-unité de la toxine diphtérique sous le contrôle du promoteur du gène de l’UCP1 [3, 13]. Dans ces conditions, les adipocytes bruns sont détruits, ce qui permet d’évaluer leur fonction in vivo. Or, comme il a été dit précédemment, les souris UCP1−/−, et particulièrement les femelles, étaient extrêmement sensibles au froid. Les autres souris avaient des problèmes de reproduction difficilement explicables par le seul rôle dans la thermogenèse attribué à l’UCP1, ce qui nous a poussé à rechercher l’expression d’UCP1 dans d’autres tissus [14]. C’est ainsi que l’expression d’UCP1 (protéine et ARNm) a pu être mise en évidence dans l’utérus chez la souris et la ratte. L’analyse immunocytochimique ainsi que l’hybridation in situ ont révélé que cette protéine était exprimée dans des cellules musculaires lisses et, de manière étonnante, uniquement dans celles qui constituent la couche longitudinale de cellules musculaires lisses. Cela est vrai dans tous les tissus disposant d’au moins deux couches de cellules musculaires lisses, ce qui est le cas de l’appareil digestif, urinaire et reproducteur, mais pas de la paroi des vaisseaux dans laquelle nous n’avons pu mettre en évidence aucune expression d'UCP1 (Figure 2).
 |
Figure 2. Analyse par immunohistochimie de l’expression de la protéine découplante UCP1 dans les cellules musculaires lisses chez la souris. A. Coupe transversale de l’utérus, B. Coupe longitudinale de l’épididyme, C. Coupe longitudinale de l’uretère. Dans tous les cas, le précipité bleu de BCIP/NBT indique la présence de la protéine spécifiquement dans les couches musculaires lisses longitudinales. D. La couche musculaire lisse de l’artère rénale en est dépourvue. |
Le contenu en UCP1 de l’utérus est stimulé par l’exposition au froid des animaux ainsi que par un traitement avec un agoniste des récepteurs β-adrénergiques - l’isoprotérénol. Ces régulations sont en tout point semblables à celles qui sont décrites dans le tissu adipeux brun. Elles peuvent être associées à un processus thermogénique, ce qui expliquerait les différences de sensibilité selon le sexe des souris UCP1−/−. Par ailleurs, le contenu en UCP1 des fractions mitochondriales purifiées à partir de l’utérus augmente après l’ovulation, ce qui pourrait suggérer un rôle pour l’UCP1 « utérine » dans les variations de température au cours du cycle sexuel, ce qui reste à confirmer.
Toutefois, la localisation très particulière de son expression, uniquement dans la couche musculaire lon-gitudinale, semblait indiquer que ce ne soit pas la seule fonction à laquelle pouvait participer UCP1 dans l’utérus. Trois données expérimentales convergentes nous suggèrent qu’UCP1 pourrait participer à la fonction contractile de ces cellules : (1) le contenu en UCP1 de l’utérus est augmenté par l’isoprotérénol dont on connaît les effets relaxants ; (2) les contractions des cellules de la couche longitudinale ont plutôt pour conséquence de faire progresser le fœtus dans l’utérus ; lors de la gestation, cette couche musculaire est relâchée alors que la couche circulaire indispensable au maintien du fœtus est contractée efficacement [15] ; (3) le contenu en UCP1 est augmenté au cours de la gestation et diminue à la naissance. Cet effet relaxant d’UCP1 pourrait être amplifié au cours de la gestation par les acides gras mobilisés à la fin de cette période pour satisfaire les besoins énergétiques, acides gras qui activent directement cette protéine. Le mécanisme par lequel UCP1 pourrait « neutraliser » les cellules musculaires lisses longitudinales (un effet d’anergie, une régulation sur les voies de signalisation…) doit être précisé. La détection d’UCP1 dans un grand nombre d’organes contractiles pourrait suggérer le même type de fonction dans ces organes, ce qui ouvre un nombre incalculable de perspectives physiologiques et physiopathologiques. À titre d’exemple, ces observations seraient tout à fait compatibles avec les troubles de la reproduction observées chez les souris knock-in pour le gène de la toxine diphtérique sous le contrôle du promoteur UCP1.
Cette étude met un terme au caractère spécifique et unique de la fonction d’UCP1 envisagé par les précédentes études. L’UCP1 du tissu adipeux brun est morte, vive l’UCP1. Elle n’est plus qu’une parmi de nombreuses protéines découplantes. Ces protéines fascinantes, capables via leur activité de découplage de la respiration mitochondriale, d’affecter l’ensemble des activités biologiques associées à la mitochondrie sont encore très mal connues. Pour UCP1, une étape importante reste à franchir : valider, dans l’espèce humaine, les résultats que nous avons obtenus chez les rongeurs. Si tel était le cas, l’UCP1 pourrait avoir chez l’homme une importance physiopathologique considérable (troubles digestifs, troubles de la reproduction), loin des frontières où nous l’avons trop longtemps étudiée, cantonnée et oubliée.
Références
- Nicholls DG, Locke RM. Thermogenic mechanisms in brown fat. Physiol Rev 1984; 64 : 1–64. [Google Scholar]
- Ricquier D, Casteilla L, Bouillaud F. Molecular studies of the uncoupling protein. Faseb J 1991; 5 : 2237–42. [Google Scholar]
- Enerback S, Jacobsson A, Simpson EM, et al. Mice lacking mitochondrial uncoupling protein are cold-sensitive but not obese. Nature 1997; 387 : 90–4. [Google Scholar]
- Fleury C, Neverova M, Collins S, et al. Uncoupling protein-2: a novel gene linked to obesity and hyperinsulinemia. Nat Genet 1997; 15 : 269–72. [Google Scholar]
- Laloi M, Klein M, Riesmeier JW, et al. Plant coldinduced uncoupling protein. Nature 1997; 389 : 135–6. [Google Scholar]
- Boss O, Samec S, Paoloni-Giacobino A, et al. Uncoupling protein-3: a new member of the mitochondrial carrier family with tissue-specific expression. FEBS Lett 1997; 408 : 39–42. [Google Scholar]
- Ricquier D, Bouillaud F. The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP. Biochem J 2000; 345 : 161–79. [Google Scholar]
- Ricquier D, Bouillaud F. Mitochondrial uncoupling proteins: from mitochondria to the regulation of energy balance. J Physiol 2000; 529 : 3–10. [Google Scholar]
- Negre-Salvayre A, Hirtz C, Carrera G, et al. A role for uncoupling protein-2 as a regulator of mitochondrial hydrogen peroxide generation. Faseb J 1997; 11 : 809–15. [Google Scholar]
- Cline GW, Vidal-Puig AJ, Dufour S, Cadman KS, Lowell BB, Shulman GI. In vivo effects of uncoupling protein-3 gene disruption on mitochondrial energy metabolism. J Biol Chem 2001; 276 : 20240–4. [Google Scholar]
- Arsenijevic D, Onuma H, Pecqueur C, et al. Disruption of the uncoupling protein-2 gene in mice reveals a role in immunity and reactive oxygen species production. Nat Genet 2000; 26 : 435–9. [Google Scholar]
- Zhang CY, Baffy G, Perret P, et al. Uncoupling protein-2 negatively regulates insulin secretion and is a major link between obesity, beta cell dysfunction, and type 2 diabetes. Cell 2001; 105 : 745–55. [Google Scholar]
- Lowell, BB, Hamann A, Lawitts JA, et al. Development of obesity in transgenic mice after genetic ablation of brown adipose tissue. Nature 1993; 366 : 740–2. [Google Scholar]
- Nibbelink M, Moulin K, Arnaud E, Duval C, Pénicaud L, Casteilla L. Brown fat UCP1 is specifically expressed in uterine longitudinal smooth muscle cells. J Biol Chem 2001; 276 : 47291–5. [Google Scholar]
- Riemer RK, Heymann MA. Regulation of uterine smooth muscle function during gestation. Pediatr Res 1998; 44 : 615–27. [Google Scholar]
- Casteilla L, Rigoulet M, Penicaud L. Mitochondrial ROS metabolism: modulation by uncoupling proteins. IUBMB Life 2001; 52 : 181–8. [Google Scholar]
Liste des figures
 |
Figure 1. Schéma de fonctionnement d’une mitochondrie en l’absence ou en présence d’UCP1. A. Dans la majorité des mitochondries, le transfert des électrons d’un complexe à l’autre (C I, C II, C III, C IV) de la chaîne respiratoire est associé à l’expulsion de protons dans l’espace intermembranaire. L’accepteur final de ces électrons est l’oxygène qui donnera alors des molécules d’eau. La membrane interne étant très peu perméable aux protons, ceux-ci s’accumulent et engendrent un gradient électrochimique qui sera utilisé par l’ATP synthase pour transformer cette énergie en molécule d’ATP : la consommation d’oxygène (autrement dit la respiration) est couplée à la production d’ATP. Au cours du transfert d’électrons, il y aura obligatoirement la production d’anions superoxyde (O2-) au niveau des complexes I et surtout III. L’intensité de cette production est fonction des contraintes exercées sur ces complexes [15]. B. Dans les cellules qui expriment UCP1, cette protéine s’insère sous forme dimérique dans la membrane interne et agit comme un canal à protons qui dissipe le gradient électrochimique dû au fonctionnement de la chaîne respiratoire sans permettre la synthèse d’ATP : l’énergie sera libérée sous forme de chaleur, la respiration est découplée de la synthèse d’ATP. L’activité d’UCP1 est contrôlée de manière importante par le coenzyme Q, ce qui pourrait suggérer que dans les mitochondries qui contiennent ce type de protéines, celles-ci font partie intégrante de la chaîne respiratoire et permettraient une régulation fine et complexe du fonctionnement de celle-ci [16]. UQ : ubiquinone ; cyt-c : cytochrome c. |
| Dans le texte | |
 |
Figure 2. Analyse par immunohistochimie de l’expression de la protéine découplante UCP1 dans les cellules musculaires lisses chez la souris. A. Coupe transversale de l’utérus, B. Coupe longitudinale de l’épididyme, C. Coupe longitudinale de l’uretère. Dans tous les cas, le précipité bleu de BCIP/NBT indique la présence de la protéine spécifiquement dans les couches musculaires lisses longitudinales. D. La couche musculaire lisse de l’artère rénale en est dépourvue. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




