| Numéro |
Med Sci (Paris)
Volume 41, Numéro 6-7, Juin-Juillet 2025
|
|
|---|---|---|
| Page(s) | 596 - 600 | |
| Section | Repères | |
| DOI | https://doi.org/10.1051/medsci/2025079 | |
| Publié en ligne | 7 juillet 2025 | |
Pierre Tiollais (1934-2024), un pionnier du génie génétique et une vie consacrée au virus de l’hépatite B
Pierre Tiollais (1934-2024), a pioneer in genetic engineering with a lifelong commitment to the hepatitis B virus
1
University of South Florida, Tampa, États-Unis, Global virus network
2
École normale supérieure, Université Paris sciences & lettres, Institut de biologie de l’École normale supérieure, Paris, France
3
Collège de France, Inserm/CNRS U944, Université Paris sciences & lettres, Université Paris Cité, AP-HP, Hôpital St-Louis, Paris, France
4
Inserm U993, Paris, France
5
Institut Pasteur, Paris, France
6
Sebia, Lisses, France
7
Génomique métabolique, Génoscope, Institut François Jacob, CEA, CNRS, Université d’Évry, Université Paris-Saclay, Évry, France
Pierre Tiollais, médecin et biologiste français, est décédé le 5 août 2024 à l’âge de 89 ans. Il a marqué l’histoire de la médecine par sa contribution au clonage et au séquençage du génome du virus del’hépatite B (VHB), ainsi que par le développement d’un des premiers vaccins recombinants contre ce virus. Professeur à l’Institut Pasteur et à l’Université Paris VII (maintenant Université Paris Cité), il a joué un rôle clé dans l’utilisation de la biologie moléculaire et du génie génétique, notamment dans la lutte contre le VHB et le virus de l’immunodéficience humaine (VIH). Son travail a contribué à sauver des millions de vies humaines grâce à des campagnes de vaccination. Pierre Tiollais était aussi reconnu pour son mentorat bienveillant et son engagement au service de la communauté scientifique.
Abstract
Pierre Tiollais, a French physician-biologist, died on August 5, 2024, at 89. He is celebrated for cloning and sequencing the hepatitis B virus (HBV) genome and developing one of the first recombinant HBV vaccines. Professor at the Pasteur Institute and the University Paris VII (now University Paris Cité), Pierre Tiollais has played a key role in the application of molecular biology and genetic engineering in medical research, notably in the fight against HBV and human immunodeficiency virus (HIV). His work has helped saving millions of lives through vaccination campaigns. Pierre Tiollais was also renowned for his benevolent mentorship and commitment to the scientific community.
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Pierre Tiollais).
Pierre Tiollais, médecin et biologiste français, est décédé le 5 août 2024 à l’âge de 89 ans. Son nom restera gravé dans l’histoire de la médecine pour sa contribution majeure au clonage et au séquençage du génome du virus de l’hépatite B (VHB). Il a également joué un rôle clé dans le développement d’un des premiers vaccins recombinants contre ce virus. Né le 8 décembre 1934 à Rennes, en Bretagne, dans une famille de pharmaciens, Pierre Tiollais est resté profondément attaché à sa région d’origine, qu’il évoquait avec fierté et parfois espièglerie, s’identifiant volontiers comme « un Breton ».
Après des études de médecine commencées à Rennes, Pierre poursuit par un internat en hématologie des Hôpitaux de Paris, avant d’obtenir son diplôme de docteur en médecine à l’Université de Paris en 1968. Entre temps, à la suite de son séjour sous les drapeaux en Algérie, au cours duquel il frôle la mort, il décide de faire une pause dans ses études de médecine et de se tourner vers la biologie. Il s’inscrit alors à la Faculté de biologie de Jussieu (aujourd’hui Sorbonne Université), où il se passionne pour la biochimie, une discipline qu’il chérira tout au long de sa carrière. En 1973, il devient d’ailleurs professeur de biochimie à la Faculté de médecine de Lariboisière, Université Paris VII.
Sa carrière scientifique débute à l’Inserm en 1967, puis, en 1973, il rejoint le laboratoire dirigé par Henri Buc dans le nouveau département de biologie moléculaire à l’Institut Pasteur, sur la suggestion de François Gros. Convaincu du potentiel du génie génétique naissant pour l’avenir des sciences biologiques et médicales, Pierre effectue également un stage dans le groupe de Richard Roberts au Cold Spring Harbor Laboratory, aux États-Unis, pour y apprendre à produire et utiliser les enzymes de restriction. C’est dans ce contexte qu’il devient l’un des pionniers des techniques de l’ADN recombinant en France, développant avec Alain Rambach en 1974 le premier vecteur de clonage dérivé du virus bactériophage lambda [1].
Jacques Monod, alors directeur de l’Institut Pasteur, soutient entièrement le développement des techniques d’ingénierie génétique, et décide en 1976 de la création d’une unité de génie génétique, dans laquelle Pierre Tiollais prend la direction d’un des groupes fondateurs. Dans la foulée de la conférence d’Asilomar [2, 3], qui pose les fondations de l’emploi des techniques de l’ADN recombinant, à laquelle Pierre Tiollais assiste en compagnie, en particulier, de Philippe Kourilsky, et de la mise en place en France d’une commission réglementant les expérimentations impliquant de l’ADN recombinant, il devient clair que certaines des expérimentations envisagées par les groupes de l’unité de génie génétique devront être effectuées dans un laboratoire au niveau de confinement dit P3 (aujourd’hui BSL-3). Pierre Tiollais, qui s’est formé à la conception de telles installations de biosécurité à l’Université d’Uppsala, en Suède, convainc, avec Philippe Kourilsky, Jacques Monod de faire construire un tel laboratoire P3 à l’Institut Pasteur, le premier en France. Du fait de son confinement, on l’appellera familièrement le « sous-marin ».
Dans un premier temps, Pierre Tiollais va utiliser ces nouvelles techniques de clonage pour étudier l’organisation du génome de différentes souches d’adénovirus, avec Michel Perricaudet, d’abord dans un laboratoire de haute sécurité suédois, puis à Paris dans le sous-marin, lorsque celui-ci sera fonctionnel [4–6].
Mais la formation médicale de Pierre le pousse à appliquer directement les avancées du génie génétique à un problème majeur de santé publique. Sur les conseils de son mentor d’internat en médecine, Jean Bernard, puis de Jacques Monod et François Gros, il décide de se tourner vers l’étude du virus de l’hépatite B, véritable fléau à l’échelle planétaire, mais dont la biologie est alors mal caractérisée et le génome encore inconnu. Apprenant que Baruch Blumberg, découvreur de l’antigène Australia (ou antigène de surface du VHB), était en transit à Paris, Pierre se rend à l’aéroport de Roissy pour rencontrer le lauréat du prix Nobel (Figure 1). Avec l’aide de Jesse Summers du Fox Chase Cancer Center à Philadelphie, l’équipe de Pierre Tiollais purifie l’ADN viral, puis le clone dans un bactériophage lambda, et établit en 1979, en collaboration avec le laboratoire dirigé par Francis Galibert à l’Hôpital Saint-Louis à Paris et dans un contexte de compétition internationale intense, la première séquence nucléotidique du génome complet [7, 8], offrant accès à la séquence peptidique de l’antigène de surface du virus (AgHBs, antigène vaccinal) [9]. Le clonage et l’établissement de la séquence nucléotidique du génome du VHB et la détermination de l’organisation de ce génome vont alors ouvrir la voie à de multiples applications décisives, dans lesquelles Pierre Tiollais va prendre une place prépondérante.
 |
Figure 1 Lettre de Baruch Blumberg à Pierre Tiollais de 1977 pour lui donner rendez-vous à l’aéroport Roissy Charles de Gaulle (© Irène Tiollais, collection privée). |
Parallèlement, Pierre Tiollais devient directeur de l’unité de recombinaison et expression génétiques (UREG), un laboratoire mixte entre l’Inserm, le CNRS et l’Institut Pasteur (Figure 2). En 1980, son équipe fait une découverte majeure en identifiant des séquences d’ADN du VHB intégrées dans l’ADN cellulaire de carcinomes hépatocellulaires humains (CHC), la forme la plus fréquente de cancer du foie [10]. Cette découverte apporte un argument clé en faveur du lien causal entre le VHB et le cancer du foie. L’équipe montre par la suite que l’intégration de l’ADN du VHB peut s’effectuer au voisinage de gènes cellulaires, altérant leur niveau d’expression ou leur fonction, contribuant à la transformation des hépatocytes, et ouvrant ainsi la voie à l’hypothèse d’une mutagénèse insertionnelle [11, 12]. Cette hypothèse sera étayée par les résultats obtenus dans un modèle animal étudié au laboratoire par le groupe de Marie-Annick Buendia. En effet, dans les CHC induits par le virus del’hépatite de la marmotte des Appalaches (woodchuck hepatitis virus, WHV), de la même famille que le VHB, la mutagenèse insertionnelle de gènes de la famille myc (C-myc, N-myc, N-myc2) est retrouvée dans plus de 80 % des cas [13–16]. En parallèle, la découverte du gène du récepteur β de l’acide rétinoïque (RARB), ciblé par une intégration du génome du VHB dans un cancer du foie, permettra au laboratoire de poursuivre des travaux sur les récepteurs nucléaires par le clonage du gène PML (promyelocytic leukemia) et de l’oncogène PML-RARA (retinoic acid receptor α), consécutif à la translocation t (15;17)(q22;q21) à l’origine du développement des leucémies aigües promyélocytaires [17, 18].
 |
Figure 2 Pierre Tiollais dans son bureau de l’Institut Pasteur, à Paris, dans les années 1980 (© Irène Tiollais, collection privée). |
À la fin des années 1970, le laboratoire dirigé par Pierre Tiollais est régulièrement sollicité par des laboratoires de biochimie et de biologie moléculaire pour contribuer à des projets de clonage d’ADN complémentaires (ADNc). Cette technique a été développée par François Rougeon et Bernard Mach à Genève (Suisse) [19]. L’installation du groupe de François Rougeon dans l’unité de génie génétique ouvrira la porte à la réalisation de plusieurs projets de clonage d’ADNc dans le laboratoire dirigé par Pierre Tiollais [20–22]. À ce stade, le clonage des ADNc prend une importance telle que Pierre Tiollais décide de lancer à l’Institut Pasteur un cours pratique de clonage de ces molécules. Ce cours se poursuivra pendant plusieurs années et sera encadré par différents membres de l’équipe de recherche.
Le début des années 1980 constituera une période de transition pour le laboratoire, avec le démarrage de nombreux nouveaux projets, l’arrivée de nouveaux membres, mais aussi le départ de cadres importants du groupe. En 1981 Pierre Tiollais et Jean Frézal (Hôpital Necker-Enfants malades) discutent d’une collaboration dans le domaine de la génétique humaine. Cette dernière vit alors une véritable révolution avec l’introduction des techniques d’ADN recombinant [23]. À nouveau, c’est à Pierre Tiollais, le médecin expert en génie génétique, qu’il est fait appel. Après avoir envisagé un projet sur le gène responsable du rétinoblastome humain, il sera finalement décidé d’aborder la question de la détermination du sexe chez les mammifères en s’appuyant sur l’étude moléculaire du chromosome Y humain et de diverses anomalies de détermination du sexe. Ce sujet, mené en collaboration avec le groupe de Marc Fellous à l’Institut Pasteur, s’avèrera riche en observations majeures, comme la présence de fragments du chromosome Y chez des sujets de sexe masculin avec un caryotype 46, XX [24] (→).
(→) Voir m/s n° 10, 2024, page 748
Peu après, sera mise en évidence l’existence d’une recombinaison génétique entre les chromosomes X et Y humains au cours de la méiose [25]. Ainsi l’UREG prendra-t-elle une part importante dans la montée en puissance d’une discipline en pleine mutation sur le plan international. Très modestement, Pierre Tiollais a toujours voulu rester en retrait dans la genèse et l’évolution du « projet chromosome Y », qui s’est développé en totale liberté, tout en bénéficiant des compétences et de la manne généreuse de l’unité de recherche.
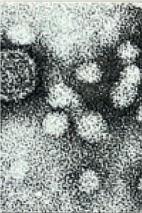
L’engagement principal de Pierre Tiollais demeure cependant le VHB. Après le clonage du génome viral, il aborde la production de l’AgHBs (Figure 3), en vue du développement d’un vaccin recombinant contre l’hépatite B, susceptible de pallier les problèmes posés par l’utilisation d’antigènes viraux issus du sérum de porteurs dits « sains ». Avec Christine Pourcel et Marie-Françoise Dubois, il obtient en 1980 la synthèse et la sécrétion de l’antigène de surface du virus par des cellules murines, sous la forme de particules semblables à celles présentes dans le sang des malades [26]. À la suite de cette découverte, s’engage alors une recherche intense dans le laboratoire G3 (groupement de génie génétique), dirigé par Pierre Tiollais, puis par Rolf Streeck, afin de mettre au point un vaccin recombinant compatible avec un développement industriel. L’obtention d’une lignée de cellules CHO (dérivées de l’ovaire du hamster chinois Cricetulus griseus) produisant de manière stable l’AgHBs pose les bases d’un transfert éventuel vers l’industrie. En collaboration avec David Milich et Francis Chisari, de la Scripps Clinic and Research Foundation, à La Jolla, aux États-Unis, l’équipe de Pierre Tiollais établit que ces particules composées d’antigène majeur et de la moyenne protéine d’enveloppe du VHB sont fortement immunogènes chez la souris [27, 28], ouvrant ainsi la voie au développement clinique du vaccin, qui sera mis sur le marché en 1986 par Pasteur vaccins, puis par Sanofi. À la même période, des groupes américains mettaient également au point un vaccin recombinant contre l’hépatite B en produisant l’AgHBs dans les cellules de la levure Saccharomyces cerevisiae [29–31] (→).
(→) Voir m/s n° 10, 2024, page 748
 |
Figure 3 Support de diapositive confectionné par Pierre Tiollais, comprenant des prises de vue des particules du virus del’hépatite B (VHB) par microscopie électronique, une immunoempreinte des protéines contenues dans ces particules, et des représentations schématiques de celles-ci (© Irène Tiollais, collection privée). |
Depuis lors, des campagnes de vaccination massives ont été menées, évitant des dizaines de millions de décès, notamment dans les pays à revenu faible et intermédiaire, où l’hépatite B est endémique [32]. Pierre Tiollais considérait avec fierté ce bilan humain remarquable.
Enfin, un dernier aspect, moins connu, de la carrière de Pierre Tiollais est sa contribution au clonage et au séquençage nucléotidique des génomes du VIH et du VIS (virus de l’immunodéficience simienne) au début de l’épidémie de SIDA (syndrome d’immunodéficience acquise), en collaboration avec Luc Montagnier et Françoise Barré-Sinoussi à l’Institut Pasteur, un apport crucial à la connaissance de ces rétrovirus [33, 34]. Pierre Tiollais a reçu de nombreuses récompenses prestigieuses, dont le prix de la Fondation Athéna-Institut de France, le grand prix de la Fondation pour la recherche médicale, et le grand prix de l’Institut électricité santé. Membre de l’Académie des sciences depuis 1991 (Figure 4), de l’Académie de médecine depuis 1996, et de l’Académie chinoise d’ingénierie depuis 1998, il a marqué son domaine de prédilection de son empreinte.
 |
Figure 4 Jean Bernard (à gauche) et Alain Pompidou remettent son épée d’académicien à Pierre Tiollais dans l’ancienne bibliothèque de l’Institut Pasteur, à Paris en 1992 (© Irène Tiollais, collection privée). |
Tout au long de sa carrière, Pierre Tiollais a eu un sens profond du bien commun, et a toujours estimé qu’il était de son devoir de partager les avancées scientifiques. Il a été l’un des premiers organisateurs du congrès international sur le VHB, qui se tient toujours chaque année. Très engagé, il a également visité fréquemment les régions du monde où le VHB est endémique, comme l’Afrique subsaharienne et l’Extrême-Orient. Il est devenu l’ambassadeur le plus connu du génie génétique et de la biologie du VHB en Chine, où il a entretenu une collaboration fructueuse de quatre décennies avec les chercheurs Zaiping Li et Yuan Wang. C’est ainsi que Pierre Tiollais, dans son sillon de précurseur, contribuera de façon éminente au développement de la science moderne dans une Chine alors bien en retard dans la recherche biomédicale, en organisant au cours de la décennie 1980 et avec le soutien de l’Inserm un cours de génie génétique au Shanghai Institute of Biochemistry and Cell Biology de l’Académie chinoise des sciences (Figure 5). De nombreux membres de l’UREG formeront successivement les équipes enseignantes de ce cours.
 |
Figure 5 Pierre Tiollais donnant un cours de biologie moléculaire dans les locaux de Shanghai Institute of Biochemistry and Cell Biology à Shanghai, en Chine (© Irène Tiollais, collection privée). |
Pierre Tiollais a toujours valorisé la simplicité, la spontanéité et l’absence de hiérarchie dans son laboratoire, donnant une totale autonomie à ses jeunes collaborateurs : « Si un scientifique veut peindre un mur en vert, qu’on le laisse le peindre en vert », disait-il souvent. Son laboratoire, à la fois dynamique et pluridisciplinaire, a participé à la formation de nombreux leaders scientifiques qui, sous l’œil bienveillant de Pierre, ont représenté ce que l’on a pu nommer « l’école Tiollais ». Pierre Tiollais s’est toujours soucié du personnel de son laboratoire. La disparition de plusieurs de ses membres dans les années 1980 l’a profondément affecté. Ceux qui ont eu la chance de travailler à ses côtés se souviendront de lui comme d’un mentor généreux, modeste et chaleureux.
Remerciements
Nous remercions Irène et Romain Tiollais pour leurs conseils dans la rédaction de cet article, ainsi que pour nous avoir donné accès à certains documents qui l’illustrent.
Contribution des auteurs
Tous les auteurs ont contribué à la rédaction et à la relecture du manuscrit.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Rambach A, Tiollais A. Bacteriophage lambda having EcoRI endonuclease sites only in the nonessential region of the genome. Proc Natl Acad Sci U S A 1974; 71 : 3927–30. [CrossRef] [PubMed] [Google Scholar]
- Berg P. Meetings that changed the world: Asilomar 1975, DNA modification secured. Nature 2008; 455 : 290–1. [CrossRef] [PubMed] [Google Scholar]
- Philipson L, Tiollais P. Rational containment on recombinant DNA. Nature 1977; 268 : 90–1. [PubMed] [Google Scholar]
- Tiollais P, Perricaudet M, Pettersson U, Philipson L. Propagation in E. coli of bacteriophage lambda with integrated fragments of adenovirus 2 DNA. Gene 1976; 1 : 49–63. [CrossRef] [PubMed] [Google Scholar]
- Perricaudet M, Fritsch A, Pettersson U, et al. Excision and recombination of adenovirus DNA fragments in Escherichia coli. Science 1977; 196 : 208–10. [CrossRef] [PubMed] [Google Scholar]
- Perricaudet M, Le Moullec J, Tiollais P, Pettersson U. Structure of two adenovirus type 12 transforming polypeptides and their evolutionary implications. Nature 1980; 288 : 174–6. [CrossRef] [PubMed] [Google Scholar]
- Charnay P, Pourcel C, Louise A, et al. Cloning in Escherichia coli and physical structure of hepatitis B virion DNA. Proc Natl Acad Sci U S A 1979; 76 : 2222–6. [CrossRef] [PubMed] [Google Scholar]
- Galibert F, Mandart E, Fitoussi F, et al. Nucleotide sequence of the Hepatitis B virus genome (subtype ayw) cloned in E. coli. Nature 1979; 281 : 646–50. [CrossRef] [PubMed] [Google Scholar]
- Charnay P, Mandart E, Hampe A, et al. Localization on the viral genome and nucleotide sequence of the gene coding for the two major polypeptides of the hepatitis B virus surface antigen (HBsAg). Nucl Acids Res 1979; 7 : 335–46. [CrossRef] [PubMed] [Google Scholar]
- Bréchot C, Pourcel C, Louise A, et al. Presence of integrated hepatitis B virus DNA sequences in cellular DNA of human hepatocellular carcinoma. Nature 1980; 286 : 533–5. [CrossRef] [PubMed] [Google Scholar]
- Dejean A, Bougueleret L, Grzeschik KH, Tiollais P. Hepatitis B virus DNA integration in a sequence homologous to v-erbA and steroid receptor genes in a hepatocellular carcinoma. Nature 1986; 322 : 70–2. [CrossRef] [PubMed] [Google Scholar]
- de Thé H, Marchio A, Tiollais P, Dejean A. A novel steroid thyroid hormone receptor-related gene inappropriately expressed in human hepatocellular carcinoma. Nature 1987; 330 : 667–9. [CrossRef] [PubMed] [Google Scholar]
- Möröy T, Marchio A, Etiemble J, et al. Rearrangement and enhanced expression of c-myc in hepatocellular carcinoma of hepatitis virus infected woodchucks. Nature 1986; 324 : 276–9. [CrossRef] [PubMed] [Google Scholar]
- Fourel G, Trépo C, Bougueleret L, et al. Frequent activation of N-myc genes by hepadnavirus insertion in woodchuck liver tumours. Nature 1990; 347 : 294–8. [CrossRef] [PubMed] [Google Scholar]
- Wei Y, Fourel G, Ponzetto A, et al. Hepadnavirus integration: Mechanisms of activation of the N-myc2 retrotransposon in woodchuck liver tumors. J Virol 1992; 66 : 5265–76. [CrossRef] [PubMed] [Google Scholar]
- Pineau P, Marchio A, Terris B, et al. A t(3;8) chromosomal translocation associated with hepatitis B virus integration involves the carpoxypeptidase N locus. J Virol 1996; 70 : 7280–4. [CrossRef] [PubMed] [Google Scholar]
- de Thé H, Chomienne C, Lanotte M, et al. The t(15;17) translocation of acute promyelocytic leukaemia fuses the retinoic acid receptor alpha gene to a novel transcribed locus. Nature 1990; 347 : 558–61. [CrossRef] [PubMed] [Google Scholar]
- de Thé H, Lavau C, Marchio A, et al. The PML-RARα fusion mRNA generated by the t (15; 17) translocation in acute promyelocytic leukemia encodes a functionally altered RAR. Cell 1991; 66 : 675–84. [CrossRef] [Google Scholar]
- Rougeon F, Kourilsky P, Mach B. Insertion of a rabbit β-globin gene sequence into an E. coli plasmid. Nucl Acids Res 1975; 2 : 2365–78. [CrossRef] [PubMed] [Google Scholar]
- Atger M, Perricaudet M, Tiollais P, Milgrom E. Bacterial cloning of the rabbit uteroglobin structural gene. Biochem Biophys Res Commun 1980; 93 : 1082–8. [CrossRef] [Google Scholar]
- Weissenbach J, Chernajovsky Y, Zeevi M, et al. Two interferon mRNAs in human fibroblasts: in vitro translation and Escherichia coli cloning studies. Proc Natl Acad Sci U S A 1980; 77 : 7152–6. [CrossRef] [PubMed] [Google Scholar]
- Bouillaud F, Riquier D, Thibault J, Weissenbach J. Molecular approach to thermogenesis in brown adipose tissue. cDNA cloning of the mitochondrial uncoupling protein. Proc Natl Acad Sci USA 1985; 82 : 445–8. [CrossRef] [PubMed] [Google Scholar]
- Anonyme. L’Inserm, les maladies génétiques et le programme génome humain des années 1970 aux années 1990. Cahiers du Comité pour l’histoire de l’INSERM 2024; 6 : 37–40. [Google Scholar]
- Weissenbach J. Des hommes avec deux chromosomes X. Med Sci (Paris) 1985; 1 : 331. [CrossRef] [Google Scholar]
- Simmler M, Rouyer F, Vergnaud G, et al. Pseudoautosomal DNA sequences in the pairing region of the human sex chromosomes. Nature 1985; 317 : 692–7. [CrossRef] [PubMed] [Google Scholar]
- Dubois M, Pourcel C, Rousset S, et al. Excretion of hepatitis B surface antigen particles from mouse cells transformed with cloned viral DNA. Proc Natl Acad Sci U S A 1980; 77 : 4549–53. [CrossRef] [PubMed] [Google Scholar]
- Michel M, Pontisso P, Sobczak E, et al. Synthesis in animal cells of hepatitis B surface antigen particles carrying a receptor for polymerized human serum albumin. Proc Natl Acad Sci U S A 1984; 81 : 7708–12. [CrossRef] [PubMed] [Google Scholar]
- Milich D, Thornton G, Neurath A, et al. Enhanced immunogenicity of the pre-S region of hepatitis B surface antigen. Science 1985; 228 : 1195–9. [CrossRef] [PubMed] [Google Scholar]
- Valenzuela P, Medina A, Rutter W, et al. Synthesis and assembly of hepatitis B virus surface antigen particles in yeast. Nature 1982; 298 : 347–50. [CrossRef] [PubMed] [Google Scholar]
- McAleer W, Buynak E, Maigetter R, et al. Human hepatitis B vaccine from recombinant yeast. Nature 1984; 307 : 178–80. [CrossRef] [PubMed] [Google Scholar]
- Michel M. Vaccination contrel’hépatite B — Succès et perspectives. Med Sci (Paris) 2016; 32 : 739–45. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Li X, Mukandavire C, Cucunubá Z, et al. Estimating the health impact of vaccination against ten pathogens in 98 low-income and middle-income countries from 2000 to 2030: a modelling study. Lancet 2021; 397 : 398–408. [CrossRef] [PubMed] [Google Scholar]
- Alizon M, Sonigo P, Barré-Sinoussi F, et al. Molecular cloning of lymphadenopathy-associated virus. Nature 1984; 312 : 757–6. [CrossRef] [PubMed] [Google Scholar]
- Chakrabarti L, Guyader M, Alizon M, et al. Sequence of simian immunodeficiency virus from macaque and its relationship to other human and simian retroviruses. Nature 1987; 328 : 543–7. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1 Lettre de Baruch Blumberg à Pierre Tiollais de 1977 pour lui donner rendez-vous à l’aéroport Roissy Charles de Gaulle (© Irène Tiollais, collection privée). |
| Dans le texte | |
 |
Figure 2 Pierre Tiollais dans son bureau de l’Institut Pasteur, à Paris, dans les années 1980 (© Irène Tiollais, collection privée). |
| Dans le texte | |
 |
Figure 3 Support de diapositive confectionné par Pierre Tiollais, comprenant des prises de vue des particules du virus del’hépatite B (VHB) par microscopie électronique, une immunoempreinte des protéines contenues dans ces particules, et des représentations schématiques de celles-ci (© Irène Tiollais, collection privée). |
| Dans le texte | |
 |
Figure 4 Jean Bernard (à gauche) et Alain Pompidou remettent son épée d’académicien à Pierre Tiollais dans l’ancienne bibliothèque de l’Institut Pasteur, à Paris en 1992 (© Irène Tiollais, collection privée). |
| Dans le texte | |
 |
Figure 5 Pierre Tiollais donnant un cours de biologie moléculaire dans les locaux de Shanghai Institute of Biochemistry and Cell Biology à Shanghai, en Chine (© Irène Tiollais, collection privée). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




