| Numéro |
Med Sci (Paris)
Volume 38, Numéro 8-9, Août-Septembre 2022
|
|
|---|---|---|
| Page(s) | 643 - 645 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2022094 | |
| Publié en ligne | 12 septembre 2022 | |
Déviation du métabolisme énergétique et neurodégénérescence dans les maladies à prions
Corruption of energy metabolism and neurodegeneration in prion diseases
1
Université Paris Cité, Paris, France.
2
Inserm UMR-S1124, Paris, France.
3
Inserm U942, Paris France.
4
Hoffmann La Roche AG, Bâle, Suisse.
Les encéphalopathies spongiformes transmissibles, plus connues sous le nom de maladies à prions (la maladie de Creutzfeldt-Jakob et son variant, le syndrome de Gerstmann-Straüssler-Scheinker, l’insomnie fatale familiale chez l’homme), sont des maladies neurodégénératives rares, pour lesquelles il n’existe actuellement aucune solution thérapeutique. Elles sont caractérisées par l’accumulation et le dépôt, dans le système nerveux central, d’une protéine anormalement conformée et infectieuse, la protéine prion scrapie (PrPSc, par référence à la tremblante du mouton, première maladie à prions décrite au xviiie siècle). La PrPSc est toxique pour les neurones et provoque leur mort, ce qui est à l’origine des principaux signes cliniques associés aux maladies à prions : symptômes dépressifs ou anxieux, suivis de troubles cognitifs, puis de désordres moteurs. Ces symptômes apparaissent après une période d’incubation de plusieurs années, mais une fois la maladie déclarée, celle-ci progresse rapidement et mène inéluctablement à la mort en quelques mois.
La protéine PrPSc résulte de la conversion transconformationnelle de la protéine prion cellulaire PrPC, l’isoforme non pathologique des prions exprimée par les cellules de l’hôte. La protéine PrPC est ubiquitaire, bien que présente en plus grande abondance dans les neurones. Elle est attachée à la surface des cellules par une ancre glycosylphosphatidylinositol (GPI). Même s’il est démontré que PrPSc exerce sa toxicité en interférant avec le(s) rôle(s) physiologique(s) de PrPC dans les neurones, la ou les fonction(s) de PrPC demeure(nt) énigmatique(s). L’hypothèse privilégiée est que PrPC joue le rôle soit d’un récepteur ou d’un co-récepteur à la membrane plasmique, soit d’une protéine d’échafaudage capable d’assembler et de moduler l’activité de complexes de signalisation membranaires [1, 2]. L’identification de divers effecteurs de signalisation contrôlés de manière directe ou indirecte par PrPC dans les neurones a permis de proposer plusieurs fonctions pour cette protéine en lien avec l’adhérence cellulaire, la neuritogenèse et la différenciation neuronale [3], le contrôle de l’équilibre d’oxydo-réduction [4], la protection contre le stress oxydant ou le stress inflammatoire [5]. Quoi qu’il en soit, il est nécessaire de préciser le rôle de PrPC dans les neurones pour comprendre comment PrPSc provoque la neurodégénérescence dans les maladies à prions. L’enjeu est également d’une grande importance pour d’autres maladies neurodégénératives amyloïdes, car PrPC n’interagit pas uniquement avec PrPSc. Dans la maladie d’Alzheimer ou la maladie de Parkinson, PrPC capte, respectivement, les peptides Ab ou l’a-synucléine anormale, et relaie la neurotoxicité ou assure la propagation de ces amyloïdes [6].
Une nouvelle fonction physiologique de PrPC : le contrôle du métabolisme du glucose
En partant de l’analyse du protéome et du métabolome de cellules neuronales en culture dans lesquelles l’expression de PrPC a été réprimée par ARN interférence, combinée à l’analyse de cultures primaires de neurones de l’hippocampe isolés du cerveau de souris transgéniques invalidées pour le gène Prnp codant PrPC, nous avons montré que la présence de PrPC dans les neurones assure la production homéostatique d’ATP en favorisant la dégradation du glucose et la phosphorylation oxydante mitochondriale, i.e., la dégradation oxydante du glucose. Cette fonction métabolique de PrPC dépend de l’activation de la protéine kinase A (PKA). La PKA ainsi activée par PrPC inhibe la transcription du gène codant la pyruvate déshydrogénase kinase de type 4 (PDK4). Ce contrôle d’expression de PDK4 par PrPC permet notamment de maintenir un niveau d’activité élevé du complexe pyruvate déshydrogénase (PDH) mitochondrial. Une telle régulation du complexe PDH par la voie de signalisation PrPC-PKA-PDK4 assure le transfert optimal, dans la mitochondrie, du pyruvate cytosolique issu de la glycolyse, et sa conversion en acétyl-CoA en vue de sa dégradation et de la production d’ATP. Nous avons montré qu’en stimulant le flux glycolytique et la dégradation du glucose, PrPC limite la b-oxydation des acides gras, ce qui a pour conséquence de préserver l’équilibre d’oxydo-réduction des neurones [7].
Perte de la fonction régulatrice de PrPC sur le métabolisme du glucose dans l’infection à prions : contribution à la neurodégénérescence
Dans l’infection à prions, deux modèles permettent de rendre compte de la neurotoxicité de PrPSc en lien avec la corruption de fonction de PrPC. Dans le modèle perte de fonction, PrPSc annule la ou les fonction(s) physiologique(s) de PrPC sous l’effet de la conversion de PrPC en PrPSc. Dans le modèle gain de fonction, PrPSc, en interagissant avec PrPC, surstimule le(s) effecteur(s) contrôlé(s) par PrPC, portant à un niveau toxique les voies de signalisation dépendantes de cette protéine. Ces deux modèles ne sont pas mutuellement exclusifs et pourraient opérer séquentiellement ou simultanément en fonction de l’évolution et du stade de la maladie de Creutzfeldt-Jakob.
Les résultats des travaux que nous avons réalisés sur des souris C57Bl/6J infectées par la souche de prion Fukuoka (un prion issu du cerveau d’un patient atteint du syndrome de Gerstmann-Straüssler-Scheinker et adapté à la souris) plaident en faveur d’une perte de la fonction régulatrice de PrPC sur le métabolisme du glucose, qui se traduit par la reprogrammation métabolique des neurones infectés par les prions vers la b-oxydation des acides gras (Figure 1A). D’un point de vue mécanistique, PrPSc annule le contrôle négatif de PrPC sur l’expression de PDK4, ce qui provoque une forte augmentation de son activité enzymatique. PDK4 suractivée diminue l’activité du complexe PDH mitochondrial par excès de phosphorylation, ce qui a pour conséquence de ralentir l’entrée du pyruvate glycolytique dans la mitochondrie et sa dégradation. La restriction énergétique qui affecte les neurones infectés par les prions les conduit à utiliser les acides gras comme source alternative d’énergie. Mais le catabolisme important des acides gras par la b-oxydation produit des dérivés réactifs de l’oxygène et provoque l’effondrement de plusieurs systèmes anti-oxydants comme celui de la glutathion peroxydase. Il s’ensuit un stress oxydant délétère pour les neurones infectés par les prions (Figure 1A) [7].
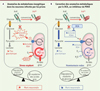 |
Figure 1. Anomalies métaboliques dans le cerveau des souris infectées par les prions. A. Dans les neurones infectés par les prions, PrPSc annule le contrôle négatif de PrPC sur l’activité pyruvate déshydrogénase kinase 4 (PDK4). PDK4 suractivée hyperphosphoryle le complexe pyruvate déshydrogénase (PDH), ce qui réduit l’activité enzymatique de ce complexe. La conséquence est un ralentissement du flux glycolytique et de la dégradation oxydante du glucose. Il s’ensuit un détournement métabolique vers la β-oxydation des acides gras (β-ox), source d’une production excessive de dérivés réactifs de l’oxygène (ROS). Les conditions de stress oxydant qui en découlent contribuent à la mort des neurones infectés. B. L’inhibition de PDK4 par le dichloroacétate (DCA) permet de corriger les anomalies métaboliques induites par l’infection à prion. La réorientation métabolique des neurones infectés vers la dégradation du glucose limite la β-oxydation des acides gras, ce qui permet de rétablir l’équilibre redox homéostatique et de diminuer la mort neuronale. TCA : cycle des acides tricarboxyliques (cycle de Krebs). |
Inhiber PDK4 avec le dichloroacétate prolonge la durée de vie des souris infectées par les prions : vers un traitement de la maladie de Creutzfeldt-Jakob ?
Lorsque les souris C57Bl/6J sont infectées expérimentalement par la souche de prion Fukuoka, la phase asymptomatique de la maladie dure environ 140 jours avant que se déclarent les symptômes, et que survienne la mort des animaux entre 160 et 170 jours (Figure 2). Afin de s’approcher d’une possible fenêtre thérapeutique chez une personne qui viendrait de déclarer des symptômes évocateurs de la maladie de Creutzfeldt-Jakob, un inhibiteur pharmacologique de PDK4, le dichloroacétate, a été injecté aux souris infectées par les prions, par voie intrapéritonéale, à partir du jour 130. Le blocage pharmacologique de PDK4 par le dichloroacétate permet d’allonger d’une vingtaine de jours la durée de vie de ces souris (Figure 2). D’un point de vue biochimique, cet effet bénéfique du dichloroacétate est associé à un rétablissement du catabolisme du glucose et à une atténuation de la b-oxydation des acides gras (Figure 1B), ce qui se traduit par une augmentation de viabilité des neurones infectés par les prions dans le cerveau des souris (Figure 2). PDK4 émerge donc comme une cible thérapeutique potentielle sur laquelle il est possible d’agir pour ralentir l’évolution de la maladie de Creutzfeldt-Jakob [7].
 |
Figure 2. Inhiber PDK4 par le dichloroacétate ralentit l’évolution des maladies à prions chez la souris. Chez les souris infectées par les prions (PrPSc), l’injection continue de dichloroacétate (DCA, 100 mg/kg/jour) à un stade tardif de la maladie (à partir du jour 130), i.e., 10 jours avant l’apparition des signes cliniques, atténue la neurodégénérescence cérébrale et allonge la durée de vie des animaux d’environ 10 %. À la dose utilisée, le dichloroacétate n’induit pas de toxicité chez les animaux témoins (cf. comparaison Témoin + DCA vs. Témoin) (barre d’échelle = 100 µm). |
Bien que les maladies à prions soient des maladies rares, le « risque prion » existe toujours et fait l’objet d’une surveillance internationale. Dans la population britannique, un individu sur 2 000 serait porteur asymptomatique des prions caractéristiques de l’encéphalopathie spongiforme bovine (à l’origine de la crise de la « vache folle » à la fin des années 1990) [8]. La maladie du dépérissement chronique est une nouvelle forme de maladie à prions qui émerge chez les cervidés, et à propos de laquelle on s’interroge sur sa capacité à franchir la barrière d’espèce [9]. Même si l’inhibition de PDK4 par le dichloroacétate ne permet pas de réduire la charge en PrPSc dans le cerveau des souris infectées [7], le dichloroacétate, en corrigeant les anomalies métaboliques, protège de la neurodégénérescence et prolonge la vie des souris infectées par les prions. Il convient de noter que ce médicament, déjà utilisé pour traiter l’acidose lactique congénitale, est actuellement testé pour son action anti-cancéreuse dans plusieurs essais cliniques [10]. Au vu de son action bénéfique chez les souris infectées par les prions, on pourrait désormais envisager de l’utiliser également pour lutter contre la maladie de Creutzfeldt-Jakob, et éventuellement contre d’autres maladies neurodégénératives amyloïdes.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Mouillet-Richard S, Ermonval M, Chebassier C, et al. Signal transduction through prion protein. Science 2000 ; 289 : 1925–1928. [CrossRef] [PubMed] [Google Scholar]
- Linden R, Martins VR, Prado MA, et al. Physiology of the prion protein. Physiol Rev 2008 ; 88 : 673–728. [CrossRef] [PubMed] [Google Scholar]
- Loubet D, Dakowski C, Pietri M, et al. Neuritogenesis: the prion protein controls beta1 integrin signaling activity. FASEB J 2012 ; 26 : 678–690. [CrossRef] [PubMed] [Google Scholar]
- Schneider B, Mutel V, Pietri M, et al. NADPH oxidase and extracellular regulated kinases 1/2 are targets of prion protein signaling in neuronal and nonneuronal cells. Proc Natl Acad Sci USA 2003 ; 100 : 13326–13331. [CrossRef] [PubMed] [Google Scholar]
- Ezpeleta J, Boudet-Devaud F, Pietri M, et al. Protective role of cellular prion protein against TNFalpha-mediated inflammation through TACE alpha-secretase. Sci Rep 2017 ; 7 : 7671. [CrossRef] [PubMed] [Google Scholar]
- Corbett GT, Wang Z, Hong W, et al. PrP is a central player in toxicity mediated by soluble aggregates of neurodegeneration-causing proteins. Acta Neuropathol 2020 ; 139 : 503–26. [CrossRef] [PubMed] [Google Scholar]
- Arnould H, Baudouin V, Baudry A, et al. Loss of prion protein control of glucose metabolism promotes neurodegeneration in model of prion diseases. PLoS Pathog 2021 ; 17 : e1009991. [CrossRef] [PubMed] [Google Scholar]
- Gill ON, Spencer Y, Richard-Loendt A, et al. Prevalent abnormal prion protein in human appendixes after bovine spongiform encephalopathy epizootic: large scale survey. BMJ 2013 ; 347 : f5675. [CrossRef] [PubMed] [Google Scholar]
- Watson N, Brandel JP, Green A, et al. The importance of ongoing international surveillance for Creutzfeldt-Jakob disease. Nat Rev Neurol 2021 ; 17 : 362–79. [CrossRef] [PubMed] [Google Scholar]
- James MO, Jahn SC, Zhong G, et al. Therapeutic applications of dichloroacetate and the role of glutathione transferase zeta-1. Pharmacol Ther 2017 ; 170 : 166–180. [CrossRef] [PubMed] [Google Scholar]
© 2022 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Anomalies métaboliques dans le cerveau des souris infectées par les prions. A. Dans les neurones infectés par les prions, PrPSc annule le contrôle négatif de PrPC sur l’activité pyruvate déshydrogénase kinase 4 (PDK4). PDK4 suractivée hyperphosphoryle le complexe pyruvate déshydrogénase (PDH), ce qui réduit l’activité enzymatique de ce complexe. La conséquence est un ralentissement du flux glycolytique et de la dégradation oxydante du glucose. Il s’ensuit un détournement métabolique vers la β-oxydation des acides gras (β-ox), source d’une production excessive de dérivés réactifs de l’oxygène (ROS). Les conditions de stress oxydant qui en découlent contribuent à la mort des neurones infectés. B. L’inhibition de PDK4 par le dichloroacétate (DCA) permet de corriger les anomalies métaboliques induites par l’infection à prion. La réorientation métabolique des neurones infectés vers la dégradation du glucose limite la β-oxydation des acides gras, ce qui permet de rétablir l’équilibre redox homéostatique et de diminuer la mort neuronale. TCA : cycle des acides tricarboxyliques (cycle de Krebs). |
| Dans le texte | |
 |
Figure 2. Inhiber PDK4 par le dichloroacétate ralentit l’évolution des maladies à prions chez la souris. Chez les souris infectées par les prions (PrPSc), l’injection continue de dichloroacétate (DCA, 100 mg/kg/jour) à un stade tardif de la maladie (à partir du jour 130), i.e., 10 jours avant l’apparition des signes cliniques, atténue la neurodégénérescence cérébrale et allonge la durée de vie des animaux d’environ 10 %. À la dose utilisée, le dichloroacétate n’induit pas de toxicité chez les animaux témoins (cf. comparaison Témoin + DCA vs. Témoin) (barre d’échelle = 100 µm). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




