Figure 1.
Télécharger l'image originale
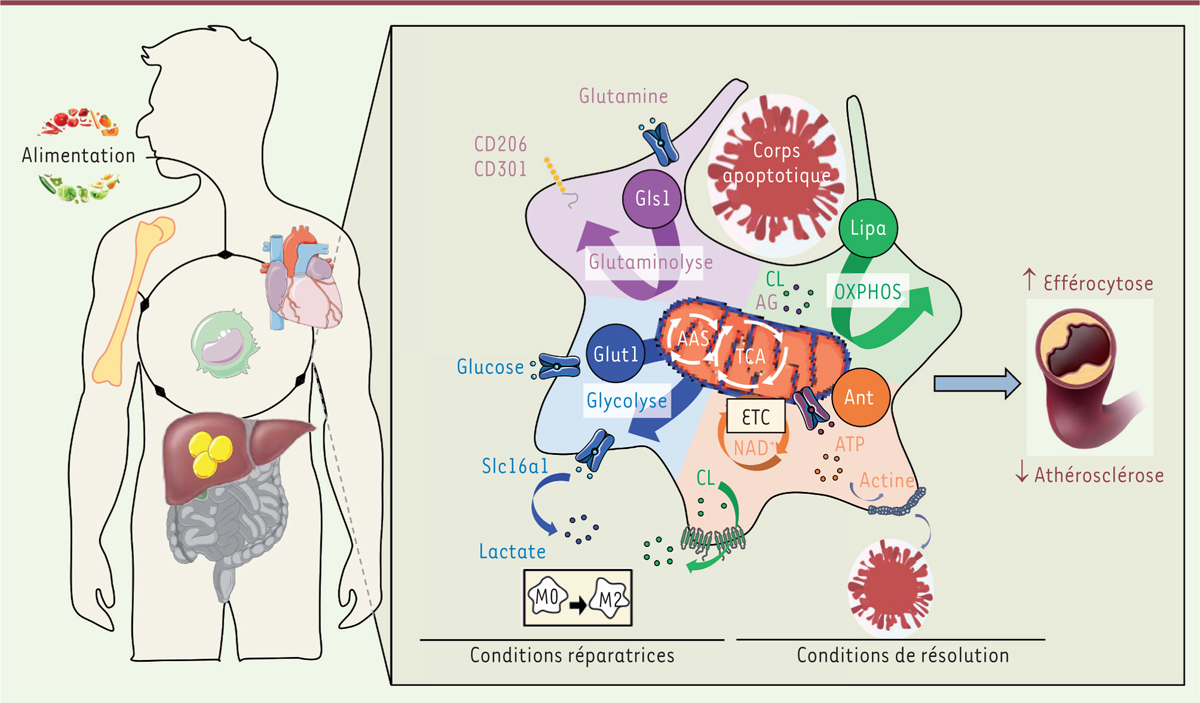
Le métabolisme des macrophages maintient leurs fonctions de clairance des corps apoptotiques (résolution) et de cicatrisation tissulaire (réparation) pour limiter l’inflammation vasculaire. Les sociétés occidentales ont connu de profonds changements concernant l’équilibre du métabolisme énergétique, en lien avec la consommation répétée d’aliments ultra-transformés, riches en sucres raffinés et en lipides, et avec la diminution de la consommation de végétaux en faveur de produits d’origine animale. Le régime de type occidental provoque une inflammation métabolique chronique caractérisée par une modification durable, quantitative et qualitative, des cellules immunitaires. Le métabolisme du foie serait un senseur d’énergie majeur de notre alimentation, et dicterait notre tonus immunitaire quotidien. En cas de surnutrition, l’apport énérgétique entraînerait une production excessive, dans la moelle osseuse, de cellules immunitaires, en particulier de monocytes et de granulocytes neutrophiles, ce qui provoque une accumulation de corps apoptotiques dans les artères et favorise la formation de plaques d’athérome. Les macrophages phagocytaires (issus de la différenciation des monocytes) y sont alors confrontés à la nécessité d’un nettoyage massif dans un environnement nutritionnel hostile. Le schéma illustre la flexibilité métabolique de ces cellules lors de l’internalisation des corps apoptotiques. L’afflux de métabolites lipidiques dans les macrophages phagocytaires active la phosphorylation oxydante (OXPHOS) mitochondriale des acides gras (AG) provenant de l’hydrolyse de ces lipides par la lipase acide des lysosomes (LIPA). Cette enzyme hydrolyse également le cholestérol libre (CL), qui pourra alors être sécrétée par la cellule et favoriser un microenvironnement tissulaire anti-inflammatoire. En parallèle, le transporteur du glucose Slc2a1 (ou Glut1) est nécessaire pour activer la glycolyse aérobie pendant l’efférocytose. Le lactate produit au cours de ce processus et libéré par le transporteur Slc16a1 peut également entraîner une signalisation anti-inflammatoire associée à l’efférocytose. En effet, des signaux du microenvironnement peuvent définir les différents états de polarisation des macrophages, allant de l’état de repos (M0) à une réponse antiinflammatoire, immunosuppressive et cicatrisante des tissus, dite condition réparatrice (M2). Dans un article récent, Merlin et al. ont montré que l’hydrolyse de la glutamine (glutaminolyse) par la glutaminase-1 (GLS1) sert non seulement de signalisation pour induire l’expression de récepteurs impliqués dans la réponse anti-inflammatoire, tels que CD206 et CD301, mais également de ‘carburant’ pour l’efférocytose. Différentes voies métaboliques cellulaires sont étroitement liées à la reprogrammation du métabolisme mitochondrial, en particulier le shunt de l’aspartate - aginino-succinate (AAS) couplé au cycle de Krebs (ou cycle des acides tricarboxyliques, TCA), qui permet de régénérer le nicotinamide adénine dinucléotide (NADH) utilisé pour transférer des électrons à la chaîne de transport d’électrons (ETC) afin de maximiser le nombre des molécules d’adénosine triphosphate (ATP) produites dans les mitochondries. L’ATP ainsi produit répond aux besoins énergétiques des réarrangements du cytosquelette impliqués dans l’élimination des nouveaux corps apoptotiques environnants, et permet ainsi la résolution de l’inflammation de la paroi des artères, ce qui prévient la formation des plaques d’athérome.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




