| Numéro |
Med Sci (Paris)
Volume 35, Numéro 10, Octobre 2019
|
|
|---|---|---|
| Page(s) | 732 - 735 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2019146 | |
| Publié en ligne | 18 octobre 2019 | |
Ki67 : un surfactant des chromosomes mitotiques
Ki67: a surfactant of mitotic chromosomes
1
CNRS-UMR 8014, Inserm U1016, groupe hospitalier Cochin-Port Royal, bâtiment Cassini, 123 boulevard de Port-Royal, 75014 Paris, France
2
Sorbonne Université, UFR 927, BC 60, 4 place Jussieu, 75252 Paris Cedex 05, France
L’antigène Ki67 a été identifié en 1983 par la recherche d’anticorps capables de reconnaître des protéines nucléaires de lymphome de Hodgkin [1]. Dès le début, il est apparu que, si cet antigène n’était pas spécifique de ces tumeurs, il n’était en revanche détectable que dans les cellules en train de proliférer (i.e. en cycle, hors phase G0), que celles-ci soient normales ou tumorales, aussi bien in vivo que in vitro [1]. Cette caractéristique a été très largement confirmée et utilisée depuis, et l’expression du gène MKI67 (au niveau protéique ou, plus rarement, ARNm) est devenue un marqueur de prolifération couramment utilisé pour des types cellulaires très variés chez l’homme ou les rongeurs, en recherche fondamentale ou clinique, ou à des fins diagnostiques ou pronostiques en cancérologie [2, 3].
Pourtant, malgré son succès en tant que marqueur, la protéine Ki67, dont la séquence est connue depuis 1993, demeurait assez peu étudiée et sa fonction largement incomprise [2]. La grande taille des deux principales isoformes codées par le gène MKI67 (3 256 et 2 896 résidus chez l’homme1) et leur sensibilité à la dégradation par les protéases compliquaient les analyses biochimiques et moléculaires [3]. Ces difficultés laissaient en suspens une question essentielle : pourquoi la présence de Ki67 est-elle strictement associée à la prolifération cellulaire ? Plusieurs observations déjà anciennes indiquaient que Ki67 est un constituant de la périphérie chromosomique, une structure correspondant à environ un tiers du volume des chromosomes mitotiques [2, 4]. Cependant, le rôle de cette structure observée depuis 130 ans demeurait assez énigmatique.
Une équipe a récemment élucidé un des rôles de Ki67 dans la périphérie chromosomique. Son travail a consisté à identifier des gènes impliqués dans la dispersion des chromosomes mitotiques [5]. Dans des cellules en mitose traitées par le nocodazole, qui empêche la formation du fuseau mitotique et bloque les cellules en prométaphase, les chromosomes se répartissent, probablement par diffusion aléatoire, dans tout le cytoplasme (l’enveloppe nucléaire n’existe plus à ce stade) (Figure 1). Cette dispersion en absence de fuseau mitotique est en réalité surprenante puisque les interactions produisant la condensation des chromosomes devraient conduire à leur regroupement [7]. Les chercheurs de cette équipe ont transfecté dans des cellules HeLa des ARN interférents (siARN) dirigés contre les ARNm codant 1 295 protéines associées à la mitose, dont 67 codant des protéines de la périphérie chromosomique. Un seul de ces siARN provoque le regroupement (coalescence2) des chromosomes, celui ciblant l’ARNm MKI67 [5]. L’implication spécifique de Ki67 dans la dispersion des chromosomes est confirmée par le fait que plusieurs siARN distincts ciblant l’ARNm MKI67 produisent le même phénotype [5]. De plus, la modification, par la technique CRISPR-Cas9 [8] (→) de la séquence cible de l’un de ces siRNA abolit l’effet de ce siARN, mais pas celui des autres siARN ciblant des régions différentes de l’ARNm MKI67 [5]. Enfin, l’invalidation de MKI67 (par la technique CRISPR-Cas9) induit également la coalescence des chromosomes mitotiques dans les cellules HeLa [5] (Figure 1).
(→) Voir la Synthèse de J.P. Tremblay, m/s n° 11, novembre 2015, page 1014
 |
Figure 1. Ki67 est essentielle à la dispersion des chromosomes mitotiques. Dans des cellules HeLa traitées par le nocodazole (bloquées en prométaphase), les chromosomes mitotiques sont dispersés dans tout le cytoplasme et bien individualisés. En revanche, dans des cellules HeLa dépourvues de protéine Ki67 par knock-down ou knock-out de MKI67 et traitées par le nocodazole, les chromosomes sont rassemblés en une masse unique et sont pratiquement immobiles. Inversement, un excès de Ki67 obtenu par surexpression transitoire provoque une dispersion accrue des chromosomes mitotiques (adapté de [5, 7]). |
Restait à savoir comment Ki67 empêche la coalescence des chromosomes. Grâce à des expériences utilisant différentes versions fluorescentes de cette protéine, les auteurs montrent qu’un grand nombre de protéines Ki67 (270 000) tapissent les chromosomes mitotiques : elles forment une sorte de « brosse » à poils longs d’environ 90 nm (approximativement l’épaisseur de la périphérie chromosomique [4]), denses (espacés en moyenne de 69 nm, soit à peu près 210 molécules par μm2) et hautement chargés positivement sur toute leur longueur (Figure 2) [5]. Ki67, dont l’expression, au cours du cycle cellulaire, est maximale en mitose [6], est en effet une protéine géante et l’une des plus basiques du protéome humain [5]. Les auteurs montrent de plus que les protéines Ki67 sont orientées par leur caractère « amphiphile », leur domaine C-terminal LR3 se liant au chromosome, et le reste de la protéine pointant vers le cytoplasme (Figure 2) [5]. Par des expériences de surexpression transitoire de Ki67 dans des cellules dépourvues du gène MKI67, les auteurs montrent enfin que la distance entre les chromosomes augmente à mesure que la densité de Ki67 augmente [5] (Figure 1). Cet effet est dû à l’accroissement du nombre de charges positives et, probablement, à l’étirement corrélatif des protéines Ki67 perpendiculairement à l’axe des chromosomes [5]. La « brosse » Ki67 s’oppose donc à la coalescence des chromosomes par répulsion stérique et électrostatique [5]. Les auteurs concluent de l’ensemble de ces données structurales et fonctionnelles que Ki67 agit comme un surfactant naturel permettant la dispersion des chromosomes mitotiques [5].
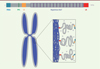 |
Figure 2. Ki67 présente les caractéristiques d’un surfactant naturel. Structure modulaire de la protéine Ki67. Le gène MKi67 code une très grande protéine, de 3 256 résidus chez l’homme, constituée de plusieurs domaines fonctionnels. FHA : forkhead-associated domain, reconnaissant des phosphopeptides ; PP1 : domaine de liaison à la protein phosphatase 1 ; CD : conserved domain ; Répétitions Ki67 : 16 répétitions imparfaites de 122 résidus contenant un motif plus conservé de 22 résidus. LR : domaine contenant 6 répétitions de la paire leucine-arginine (deux acides aminés désignés par les lettres L et R). Seule l’isoforme la plus longue est représentée [2] (adapté de [2, 9]). Les protéines Ki67 sont très chargées positivement et présentent une structure « amphiphile » : le domaine LR interagit avec la chromatine tandis que la protéine pointe vers le cytoplasme. Les protéines Ki67 forment ainsi une « brosse » assurant la dispersion des chromosomes par effet stérique et électrostatique (adapté de [5]). |
Ces résultats, outre le fait qu’ils éclairent le rôle de Ki67 et celui de la périphérie chromosomique, permettent peut-être d’élucider quelques autres mystères. Par exemple, la protéine Ki67 n’existe que chez les vertébrés, et sa séquence diffère notablement entre espèces [2, 4, 9, 10], ce qui semble surprenant pour une protéine aussi étroitement associé à un phénomène universel comme la prolifération cellulaire. Les auteurs montrent que de nombreux mutants de Ki67 présentant des délétions, voire des inversions de différentes régions, peuvent, par surexpression transitoire, compenser plus ou moins efficacement une déficience du gène MKI67 : seul le domaine LR de Ki67 est nécessaire, mais pas suffisant, pour disperser les chromosomes mitotiques [5]. Les résultats indiquent que l’efficacité des mutants augmente avec leur taille et leur charge électrique totale [5]. La relative modestie de ces contraintes est en accord avec le fait que d’autres protéines chromosomiques riches en charges positives puissent, à condition d’être fortement surexprimées, disperser les chromosomes mitotiques [5]. Il existe donc, pour cette fonction, un certain degré de redondance possible entre Ki67 et d’autres protéines chromosomiques, degré positivement corrélé à la charge et, sans doute, la taille de ces protéines [5]. Cependant, d’autres fonctions de Ki67 dans le cycle cellulaire reposent sur des contraintes structurales distinctes [2–4]. Un autre type de redondance, à un niveau plus organisationnel, contribue par ailleurs à la capacité des cellules à supporter sans trop de dommages la coalescence des chromosomes provoquée par l’absence de Ki67. La coalescence empêche les microtubules du fuseau mitotique d’accéder aux kinétochores des chromosomes, ce qui devrait empêcher la mitose [5]. Cependant, les microtubules « profitent » d’une courte fenêtre temporelle avant la coalescence, lorsque les chromosomes sont encore séparés grâce à leur accrochage à l’enveloppe nucléaire, juste avant sa disparition : en l’absence de Ki67, la mitose est plus longue, mais n’est pas bloquée [5].
Ces résultats soulèvent aussi de nouvelles questions et hypothèses. Pourquoi seul le domaine LR interagit-il avec les chromosomes [7] ? En plus de la répulsion entre les charges positives [5], existe-t-il d’autres interactions favorisant le déploiement des protéines Ki67 perpendiculairement aux chromosomes ? L’absence de Ki67 altère-t-elle aussi la structure ou la condensation des chromosomes mitotiques [4, 9] ? De plus, si les protéines Ki67 entourent les chromosomes lors de la mitose, elles se concentrent dans le nucléole pendant la majeure partie de l’interphase [2, 4, 5, 7]. Quelle est la fonction de Ki67 dans le nucléole ? Un rôle de Ki67 dans l’organisation de l’hétérochromatine périnucléolaire a été rapporté [2, 4, 10] ; les résultats résumés ici, et l’importance des phénomènes de séparation de phase dans la formation et l’organisation des nucléoles, suggèrent que Ki67 pourrait aussi jouer le rôle d’un surfactant dans cet organite [2, 5, 7]. Les nucléoles disparaissent pendant la mitose, et nombre de leurs constituants sont alors, comme Ki67, relocalisés dans la périphérie chromosomique [4, 11, 12] (→)
(→) Voir la Synthèse de D. Hernandez-Verdun et E. Louvet, m/s n° 1, janvier 2004, page 37
Une hypothèse propose que ce transit assure la répartition et la réutilisation rapide de ces constituants dans les cellules filles [4, 11]. L’absence de Ki67 perturbe la localisation de toutes les protéines de la périphérie chromosomique testées et entraîne le partage inégal entre cellules filles d’au moins une protéine majeure du nucléole, la nucléoline [2, 4, 9-11]. La couche de protéines Ki67 autour des chromosomes joue donc aussi un rôle fondamental dans l’organisation de la périphérie chromosomique et sa fonction de transport « trans-mitotique » [4].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Gerdes J, Schwab U, Lemke H, Stein H. Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation. Int J Cancer 1983 ;31 :13–20. [CrossRef] [PubMed] [Google Scholar]
- Sun X, Kaufman PD. Ki-67: more than a proliferation marker. Chromosoma 2018 ;127 :175–186. [Google Scholar]
- Cidado J, Wong HY, Rosen DM, et al. Ki-67 is required for maintenance of cancer stem cells but not cell proliferation. Oncotarget. 2016 ;7 :6281–6293. [CrossRef] [PubMed] [Google Scholar]
- Booth DG, Earnshaw WC. Ki-67 and the chromosome periphery compartment in mitosis. Trends Cell Biol 2017;27 :906–916. [Google Scholar]
- Cuylen S, Blaukopf C, Politi AZ, et al.. Ki-67 acts as a biological surfactant to disperse mitotic chromosomes. Nature 2016 ;535 :308–312. [CrossRef] [PubMed] [Google Scholar]
- Sobecki M, Mrouj K, Colinge J, et al. Cell-cycle regulation accounts for variability in Ki-67 expression levels. Cancer Res 2017 ;77 :2722–2734. [Google Scholar]
- Brangwynne CP, Marko JF. A sticky problem for chromosomes. Nature 2016 ;535 :234–235. [CrossRef] [PubMed] [Google Scholar]
- Tremblay JP. Crispr, un système qui permet de corriger ou de modifier l’expression de gènes responsables de maladies héréditaires. Med Sci (Paris) 2015 ;31 :1014–1022. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Takagi M, Natsume T, Kanemaki MT, Imamoto N. Perichromosomal protein Ki67 supports mitotic chromosome architecture. Genes Cells 2016 ;21 :1113–1124. [CrossRef] [PubMed] [Google Scholar]
- Sobecki M, Mrouj K, Camasses A, et al. The cell proliferation antigen Ki-67 organises heterochromatin. eLife 2016;5 :e13722. [CrossRef] [PubMed] [Google Scholar]
- Booth DG, Takagi M, Sanchez-Pulido L, et al. Ki-67 is a PP1-interacting protein that organises the mitotic chromosome periphery. eLife 2014 ;3 :e01641. [CrossRef] [PubMed] [Google Scholar]
- Hernandez-Verdun D, Louvet E. Le nucléole : structure, fonctions et maladies associées. Med Sci (Paris) 2004 ;20 :37–44. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2019 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Ki67 est essentielle à la dispersion des chromosomes mitotiques. Dans des cellules HeLa traitées par le nocodazole (bloquées en prométaphase), les chromosomes mitotiques sont dispersés dans tout le cytoplasme et bien individualisés. En revanche, dans des cellules HeLa dépourvues de protéine Ki67 par knock-down ou knock-out de MKI67 et traitées par le nocodazole, les chromosomes sont rassemblés en une masse unique et sont pratiquement immobiles. Inversement, un excès de Ki67 obtenu par surexpression transitoire provoque une dispersion accrue des chromosomes mitotiques (adapté de [5, 7]). |
| Dans le texte | |
 |
Figure 2. Ki67 présente les caractéristiques d’un surfactant naturel. Structure modulaire de la protéine Ki67. Le gène MKi67 code une très grande protéine, de 3 256 résidus chez l’homme, constituée de plusieurs domaines fonctionnels. FHA : forkhead-associated domain, reconnaissant des phosphopeptides ; PP1 : domaine de liaison à la protein phosphatase 1 ; CD : conserved domain ; Répétitions Ki67 : 16 répétitions imparfaites de 122 résidus contenant un motif plus conservé de 22 résidus. LR : domaine contenant 6 répétitions de la paire leucine-arginine (deux acides aminés désignés par les lettres L et R). Seule l’isoforme la plus longue est représentée [2] (adapté de [2, 9]). Les protéines Ki67 sont très chargées positivement et présentent une structure « amphiphile » : le domaine LR interagit avec la chromatine tandis que la protéine pointe vers le cytoplasme. Les protéines Ki67 forment ainsi une « brosse » assurant la dispersion des chromosomes par effet stérique et électrostatique (adapté de [5]). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




