| Numéro |
Med Sci (Paris)
Volume 35, Numéro 3, Mars 2019
|
|
|---|---|---|
| Page(s) | 209 - 212 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2019044 | |
| Publié en ligne | 1 avril 2019 | |
Visualisation en temps réel de l’infection de la muqueuse génitale par le VIH
HIV infection of the genital mucosa in real time
1
Laboratoire Entrée Muqueuse du VIH et Immunité Muqueuse, Département Infection Immunité et Inflammation, Institut Cochin, Université Paris Descartes, Sorbonne Paris Cité, 22, rue Méchain, 75014 Paris, France
2
CNRS UMR8104, 75014 Paris, France
3
Inserm U1016, Institut Cochin, 22, rue Méchain, 75014 Paris, France
Les muqueuses génitales, principale porte d’entrée du VIH-1
Le Sida (syndrome d’immunodéficience acquise) est une maladie sexuellement transmissible. Son vecteur, le virus de l’immunodéficience humain (VIH-1), est majoritairement transmis lors de rapports sexuels non protégés. Le virus est en effet présent dans les sécrétions génitales infectées. Il traverse les barrières épithéliales de la muqueuse génitale pour infecter des cellules immunitaires qui constitueront des réservoirs cellulaires pour le virus. Nos études précédentes ont suggéré que l’entrée du VIH dans l’organisme au niveau des muqueuses se fait efficacement par contact entre les cellules infectées présentes dans les sécrétions génitales infectieuses et les cellules épithéliales recouvrant les muqueuses génitales. Le virus libre, quant à lui, ne pénètre pas sauf s’il est présent en quantités bien supérieures à celles détectées dans les secrétions génitales infectieuses [1-3]. Cependant, la séquence des évènements permettant l’entrée du virus dans la muqueuse, puis l’infection des cellules immunitaires insérées dans cette muqueuse, reste mal comprise. D’autres voies d’entrée du virus au travers des muqueuses ont par ailleurs été proposées.
Muqueuse immuno-compétente reconstruite in vitro pour l’observation des premières étapes de la pénétration de la muqueuse par le VIH-1
Afin d’étudier ce processus, nous avons développé un modèle original in vitro permettant de suivre en temps réel par vidéomicroscopie multidimensionnelle en temps réel l’infection du VIH au niveau d’une muqueuse [4]. Nous avons ainsi reconstruit in vitro des tissus humains muqueux d’urètre pénien immuno-compétents et polarisés, constitués d’un épithélium cultivé sur un stroma. Celui-ci est composé de fibroblastes (tissu de soutien des cellules épithéliales) dans lequel sont insérés des macrophages, les cellules immunitaires qui caractérisent ce tissu et qui sont les premières cellules infectées par le virus à ce niveau [3]. Cette muqueuse est cultivée pendant plusieurs semaines sur un support perméable dans un système de deux chambres permettant la polarisation du tissu en reconstruction. De plus, cette méthode de culture facilite un accès sélectif à la surface de la muqueuse de l’épithélium reconstruit et permet l’inoculation directe du virus, comme in vivo, sans contact avec le stroma.
Pour suivre la pénétration virale dans la muqueuse, nous avons utilisé, comme source infectieuse, une lignée de cellules lymphocytaire T CD4+ infectées par un virus VIH-1 (gag-iGFP HIV-1) exprimant la protéine fluorescente verte (GFP) insérée au niveau de sa protéine de capside gag. En conséquence, les cellules infectées sont fluorescentes et sont aussi capables de produire des virus également fluorescents. Il est ainsi possible de visualiser les cellules infectées, mais aussi d’observer le mouvement des protéines virales de capside gag accompagnant la formation des virus prêts à bourgeonner au niveau de la membrane de la cellule infectée. D’autre part, il est possible de suivre les virus nouvellement produits qui apparaissent comme des points fluorescents.
Le virus pénètre dans l’épithelium et le traverse par transcytose suite à la formation d’une synapse virologique
En observant le processus infectieux par microscopie confocale multidimensionnelle avec ce modèle expérimental, nous avons pu suivre pour la première fois en temps réel, à l’échelle de temps de la minute, les premières étapes de l’entrée du virus dans une muqueuse génitale. Nous avons pu montrer que les cellules lymphocytaires infectées par le VIH interagissaient spécifiquement avec la surface muqueuse de l’épithélium via la protéine d’enveloppe virale qu’elles expriment à leur surface. En effet, des lymphocytes T CD4+ infectieux dépourvus de cette protéine d’enveloppe (DEnv) ne s‘attachent plus à l’épithélium. Ce contact entre les lymphocytes T CD4+ infectés et l’épithélium s’établit dans les premières 30 minutes après l’inoculation (Figure 1A). Il est suivi du recrutement des protéines de capside (que nous avons pu suivre) vers cette zone de contact, ainsi que, probablement, des protéines d’enveloppe, présentes dans la membrane plasmique des lymphocytes (Figure 1A). Ce recrutement prépare le bourgeonnement de nouveaux virus conduisant à l’apparition de nouvelles particules virales dont nous observons la libération à partir de la membrane du lymphocyte T CD4+ (Figure 1A–B). Une synapse virologique entre cellule infectée et cellule épithéliale est ainsi formée [5]. Ce type de contact infectieux est utilisé par d’autres virus comme le virus humain lymphotropique –1 (HTLV-1) par exemple (→).
(→)Voir la Synthèse de G. Rizkallah et al., m/s n° 6-7, juin-juillet 2015, page 629
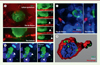 |
Figure 1. Les lymphocytes T CD4+ infectés par le VIH forment une synapse virologique avec la surface épithéliale induisant le bourgeonnement de virus qui, après transcytose à travers l’épithélium, infectent les macrophages du stroma pour former des réservoirs viraux. A. Un tissus muqueux urétral a été reconstruit à partir de fibroblastes et de macrophages primaires formant un stroma sur lequel sont cultivées des cellules épithéliales urétrales. Celles-ci sont transfectées avec la protéine de membrane plasmique ARF6-rfp (ADP-ribosylation factor 6-red fluorescent protein) permettant de visualiser spécifiquement la surface épithéliale. Des lymphocytes T CD4+ infectés avec du virus VIH-1 (virus de l’immunodéfience humaine) gag-iGFP, exprimant la protéine fluorescente verte (GFP) insérée au niveau de sa protéine de capside gag et capables de produire des virus fluorescents verts, sont inoculés sélectivement à la surface de l’épithélium. Le système est observé par microscopie confocale en temps réel et les images sont enregistrées pendant quelques heures. Le lymphocyte infecté adhère à la surface épithéliale : vue de dessus (panneau gauche en haut) et vue en coupe correspondante (panneau de gauche en bas) établissant une synapse virologique. La série de vues en coupe (panneaux côté droit) montre l’évolution dans le temps de cette synapse virologique (temps indiqués en minutes) ; les flèches blanches indiquent des virus nouvellement bourgeonnés suite à la formation de la synapse virologique. B. Autre exemple d’un lymphocyte T CD4+ infecté par le virus (gag-iGFP) visualisé en vert, formant une synapse virologique avec l’épithélium, identifié par ses noyaux marqués par du Hoechst 33258 (marquage bleu) à différents temps ; les flèches blanches indiquent des virus nouvellement bourgeonnés suite à la formation de la synapse virologique. C. Exemple d’un lymphocyte T CD4+ infecté par le virus gag-iGFP (marquage vert) formant une synapse virologique avec l’épithélium visualisé par ses noyaux marqués par le Hoechst 33258 (marquage bleu). Dans ce cas, avant insertion dans la reconstruction muqueuse, les macrophages ont été marqués grâce à l’endocytose de particules fluorescentes rouges (quantum dots) qui restent à l’intérieur de la cellule pendant plusieurs semaines. Ces macrophages reconnaissables par leur contenu en quantum dots (marquage rouge) apparaissent localisés à la surface séreuse (basale) de la cellule épithéliale avec laquelle le lymphocyte T CD4+ infecté a formé une synapse au pôle muqueux (apical) de l’épithélium. Une vue du dessus et sa vue en coupe correspondante sont montrées. D.Macrophage infecté de manière latente formant un réservoir viral dans le stroma de la muqueuse. Après transcytose du virus formé à la synapse virologique, les macrophages capturent le virus à sa sortie de l’épithélium et sont infectés de manière productive ; l’infection devient ensuite latente. Un tel macrophage réservoir localisé dans le stroma est détecté deux semaine après l’inoculation virale. Les tissus ont été fixés et immunomarqués avant d’être observés par microscopie confocale ; une reconstruction tridimensionnelle du signal observé est proposée. Le macrophage est identifié par l’expression du marqueur CD68 (marquage rouge), les virons (marquage vert) sont concentrés dans ce qui ressemble à un compartiment VCC (virus containing compartment). Le noyau est marqué en bleu. |
À notre surprise, le virus VIH-1 bourgeonne pour être relargué de manière latérale, à la surface de l’épithélium (Figure 1B), mais pas dans l’espace synaptique qui s’établit entre cellule infectée et cellule épithéliale, comme le suggérait des études morphologiques réalisées sur des cellules fixées. Cependant, ces virus nouvellement produits sont ensuite internalisés par les cellules épithéliales et transportés vers le pôle basal de l’épithélium par transcytose, puis libérés dans le stroma.
Le virus transcytosé infecte les macrophages tissulaires qui deviennent des réservoirs viraux
En parallèle à la formation de la synapse virologique et à la transcytose des virus nouvellement formés, les macrophages du stroma commencent également à se mouvoir en réponse à des signaux qui restent cependant à caractériser [6] (→).
(→) Voir la Nouvelle de C. Vérollet et al. m/s n° 8-9, août-septembre 2015, page 730
À leur sortie de la cellule épithéliale, les virus transcytosés seront internalisés par ces macrophages qui seront alors infectés (Figure 1C). Ainsi, 15 jours après l’infection dans le tissu reconstruit, les macrophages ont les caractéristiques d’un réservoir viral : ils contiennent le virus sous la forme d’ADN proviral qui est intégré, comme nous l’avons montré par hybridation in situ [5], mais aussi sous forme de virions qui sont localisés dans un compartiment spécifique, appelé VCC (pour virus-containing compartment) (Figure 1D). De plus, leur activation via la stimulation du récepteur de l’immunité innée TLR-4 (Toll-like receptor-4) réinitie la production de virus. Ces réservoirs viraux établis in vitro au niveau des macrophages correspondent à ceux que nous avons très récemment caractérisés ex vivo sur des tissus de patients infectés par le VIH sous traitement antiviral efficace [7]. Ce sont ces réservoirs que l’on ne parvient pas à éliminer et qui empêchent l’éradication du virus in vivo chez les patients séropositifs sous traitement anti-rétroviral (combinaison de traitement antiviraux, cART) et avirémiques [7].
Ainsi, l’ensemble de ces résultats fondés sur des observations réalisées en temps réel, nous a permis, comme schématisé dans la Figure 2, de faire pour la première fois la démonstration que l’infection des macrophages par le VIH peut avoir pour origine la formation de synapses virologiques entre des lymphocytes T CD4+ infectés et la surface des cellules épithéliales de la muqueuse. Le transport transcellulaire (transcytose) du virus à travers l’épithélium conduit in fine à l’infection et à l’établissement de réservoir viraux dans les macrophages tissulaires du stroma. Ces observations sur les mécanismes d’entrée muqueuse du virus menant à l’établissement de réservoirs viraux, obtenues in vitro, nécessitent désormais d’être confirmées en utilisant des modèles physiologiques intégrés, en présence de sécrétions génitales, ou in vivo.
 |
Figure 2. Représentation schématique de la succession des événements observés lors de l’infection muqueuse du VIH menant à l’établissement de réservoirs viraux. L’inoculation des lymphocytes T CD4+ à la surface épithéliale de la muqueuse conduit à l’établissement de la synapse virologique (1) permettant la production de virus (2). Le virus produit est internalisé par la cellule épithéliale puis transcytosé (3). Ressortant toujours infectieux dans le stroma, le virus infecte les macrophages (4). Cette infection devient latente avec établissement des réservoirs viraux dans les macrophages du stroma ex vivo (5), réactivable par stimulation de TLR-4 (6). CCL2 : chemokine (C-C motif) ligand 2 ; IL-13 : interleukine-13 ; MCP-1 : monocyte chemoattractant protein 1 ; MF : macrophage ; VIH-1 virus de l’immunodéficience humaine ; TLR-4 : Toll-like receptor-4. |
Conclusion et perspectives
Le modèle de reconstruction de muqueuses in vitro que nous avons développé, ainsi que la technique de visualisation utilisée, ont été déterminants pour observer en temps réel la séquence d’évènements aboutissant à l’infection des cellules immunitaires cibles du VIH dans un tissu. Ce modèle pourra être étendu à l’étude d’autres infections pour comprendre les premières étapes de l’invasion d’une muqueuse par d‘autres pathogènes, virus ou bactéries (à la condition qu’ils puissent être également rendus fluorescents). Cette technique de visualisation dynamique que nous avons mise au point pourrait constituer un outil de choix pour évaluer l’efficacité de vaccins ou de médicaments qui bloqueraient la formation des synapses virologiques ou l’accès du virus aux réservoirs cellulaires, voire à leur réactivation.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Matériel supplémentaire
Vidéo d’une synapse virologique avec bourgeonnement de virus. La protéine de membrane plasmique ARF6-rfp (ADP-ribosylation factor 6-red fluorescent protein) transfectéee dans la cellule permet de visualiser spécifiquement la surface épithéliale. Des lymphocytes CD4+ infectés avec du virus gag-iGFP expriment la protéine fluorescente verte (GFP) insérée au niveau de la protéine de capside gag du virus VIH-1 (virus de l’immunodéfience humaine) et sont capables de produire des virus fluorescents verts qui bourgeonnent par salves successives. Access here
Références
- Anderson DJ. Modeling mucosal cell-associated HIV type 1 transmission in vitro. J Infect Dis 2014 ; 210 : S648–S653. [CrossRef] [PubMed] [Google Scholar]
- Bomsel M.. Transcytosis of infectious human immunodeficiency virus across a tight human epithelial cell line barrier. Nat Med 1997 ; 3 : 42–47. [CrossRef] [PubMed] [Google Scholar]
- Ganor Y, Zhou Z, Bodo J, et al. The adult penile urethra is a novel entry site for HIV-1 that preferentially targets resident urethral macrophages. Mucosal Immunol 2013 ; 6 : 776–786. [Google Scholar]
- Real F, Sennepin A, Ganor Y, et al. Live imaging of HIV-1 transfer across T cell virological synapse to epithelial cells that promotes stromal macrophage infection. Cell Rep 2018 ; 23 : 1794–1805. [CrossRef] [PubMed] [Google Scholar]
- Rizkallah G, Mahieux R, Dutartre H. Transmission intercellulaire de HTLV-1: des mécanismes loin d’être complètement élucidés. Med Sci (Paris) 2015 ; 31 : 629–637. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Vérollet C, Souriant S, Raynaud-Messina B, et al. Le VIH-1 pilote la migration des macrophages. Med Sci (Paris) 2015 ; 31 : 730–733. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Ganor Y, Real F, Sennepin A, et al. HIV-1 reservoirs in urethral macrophages of patients under suppressive antiretroviral therapy. Nat Microbiol 2019 ; doi 10.1038/s41564-018-0335-z [Google Scholar]
© 2019 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Les lymphocytes T CD4+ infectés par le VIH forment une synapse virologique avec la surface épithéliale induisant le bourgeonnement de virus qui, après transcytose à travers l’épithélium, infectent les macrophages du stroma pour former des réservoirs viraux. A. Un tissus muqueux urétral a été reconstruit à partir de fibroblastes et de macrophages primaires formant un stroma sur lequel sont cultivées des cellules épithéliales urétrales. Celles-ci sont transfectées avec la protéine de membrane plasmique ARF6-rfp (ADP-ribosylation factor 6-red fluorescent protein) permettant de visualiser spécifiquement la surface épithéliale. Des lymphocytes T CD4+ infectés avec du virus VIH-1 (virus de l’immunodéfience humaine) gag-iGFP, exprimant la protéine fluorescente verte (GFP) insérée au niveau de sa protéine de capside gag et capables de produire des virus fluorescents verts, sont inoculés sélectivement à la surface de l’épithélium. Le système est observé par microscopie confocale en temps réel et les images sont enregistrées pendant quelques heures. Le lymphocyte infecté adhère à la surface épithéliale : vue de dessus (panneau gauche en haut) et vue en coupe correspondante (panneau de gauche en bas) établissant une synapse virologique. La série de vues en coupe (panneaux côté droit) montre l’évolution dans le temps de cette synapse virologique (temps indiqués en minutes) ; les flèches blanches indiquent des virus nouvellement bourgeonnés suite à la formation de la synapse virologique. B. Autre exemple d’un lymphocyte T CD4+ infecté par le virus (gag-iGFP) visualisé en vert, formant une synapse virologique avec l’épithélium, identifié par ses noyaux marqués par du Hoechst 33258 (marquage bleu) à différents temps ; les flèches blanches indiquent des virus nouvellement bourgeonnés suite à la formation de la synapse virologique. C. Exemple d’un lymphocyte T CD4+ infecté par le virus gag-iGFP (marquage vert) formant une synapse virologique avec l’épithélium visualisé par ses noyaux marqués par le Hoechst 33258 (marquage bleu). Dans ce cas, avant insertion dans la reconstruction muqueuse, les macrophages ont été marqués grâce à l’endocytose de particules fluorescentes rouges (quantum dots) qui restent à l’intérieur de la cellule pendant plusieurs semaines. Ces macrophages reconnaissables par leur contenu en quantum dots (marquage rouge) apparaissent localisés à la surface séreuse (basale) de la cellule épithéliale avec laquelle le lymphocyte T CD4+ infecté a formé une synapse au pôle muqueux (apical) de l’épithélium. Une vue du dessus et sa vue en coupe correspondante sont montrées. D.Macrophage infecté de manière latente formant un réservoir viral dans le stroma de la muqueuse. Après transcytose du virus formé à la synapse virologique, les macrophages capturent le virus à sa sortie de l’épithélium et sont infectés de manière productive ; l’infection devient ensuite latente. Un tel macrophage réservoir localisé dans le stroma est détecté deux semaine après l’inoculation virale. Les tissus ont été fixés et immunomarqués avant d’être observés par microscopie confocale ; une reconstruction tridimensionnelle du signal observé est proposée. Le macrophage est identifié par l’expression du marqueur CD68 (marquage rouge), les virons (marquage vert) sont concentrés dans ce qui ressemble à un compartiment VCC (virus containing compartment). Le noyau est marqué en bleu. |
| Dans le texte | |
 |
Figure 2. Représentation schématique de la succession des événements observés lors de l’infection muqueuse du VIH menant à l’établissement de réservoirs viraux. L’inoculation des lymphocytes T CD4+ à la surface épithéliale de la muqueuse conduit à l’établissement de la synapse virologique (1) permettant la production de virus (2). Le virus produit est internalisé par la cellule épithéliale puis transcytosé (3). Ressortant toujours infectieux dans le stroma, le virus infecte les macrophages (4). Cette infection devient latente avec établissement des réservoirs viraux dans les macrophages du stroma ex vivo (5), réactivable par stimulation de TLR-4 (6). CCL2 : chemokine (C-C motif) ligand 2 ; IL-13 : interleukine-13 ; MCP-1 : monocyte chemoattractant protein 1 ; MF : macrophage ; VIH-1 virus de l’immunodéficience humaine ; TLR-4 : Toll-like receptor-4. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




