Figure 2.
Télécharger l'image originale
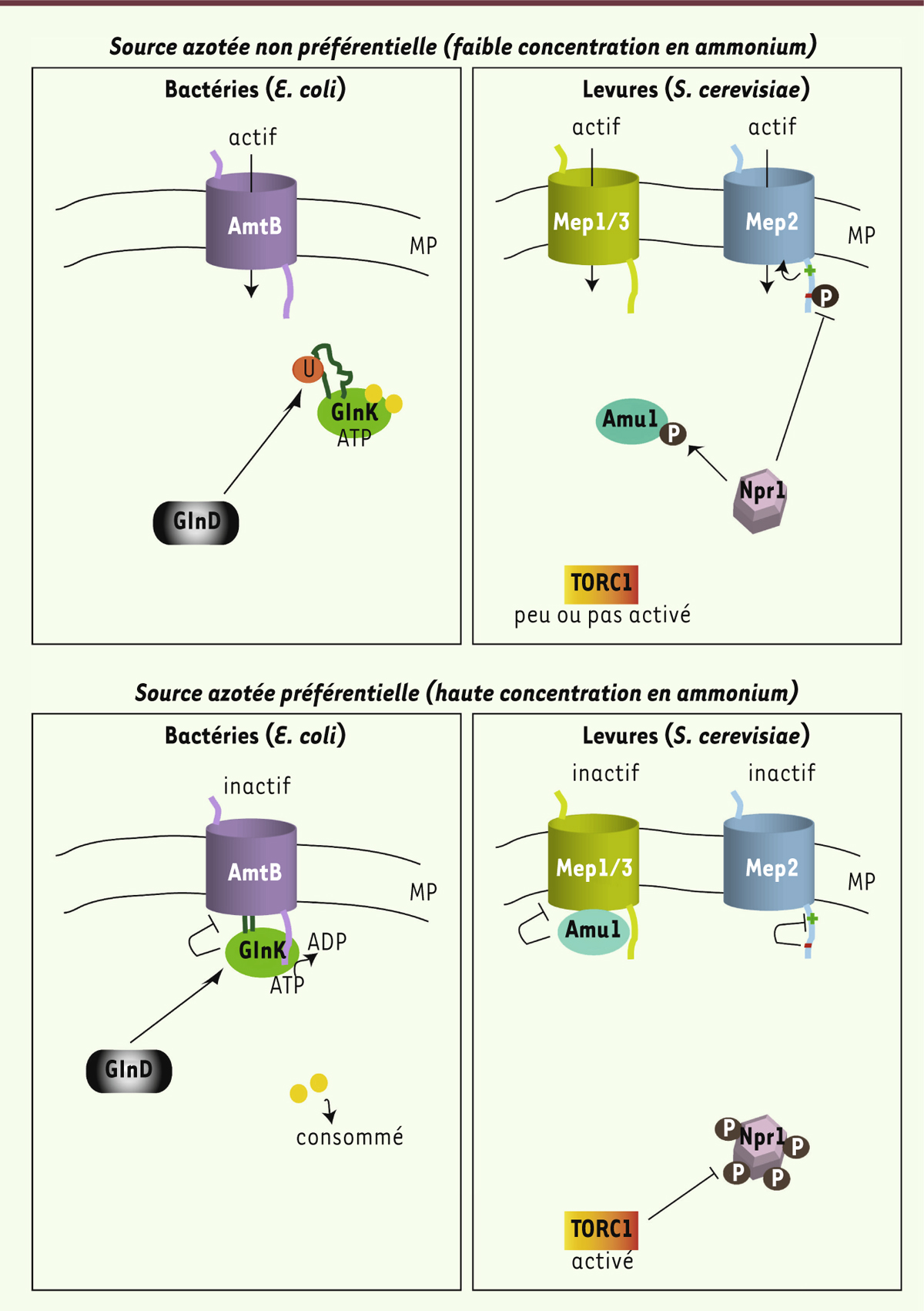
Modèles de la régulation des protéines Mep-Amt bactériennes et fongiques. Exemples d’AmtB d’Escherichia coli et Mep1, Mep2 et Mep3 de Saccharomyces cerevisiae. En haut à gauche, E. coli : en présence d’une source d’azote non préférentielle, telle qu’une limitation en ammonium, la réserve d’α-cétoglutarate (boules jaunes) est conséquente. Celui-ci se fixe à GlnK ce qui inhibe l’hydrolyse de l’ATP, la boucle T de la protéine (en vert foncé) adopte alors une structure flexible. Dans le même temps, GlnD uridylyle GlnK au niveau de la boucle T. Dans ces conditions, GlnK demeure cytosolique et AmtB est actif. En haut à droite, S. cerevisiae : en présence d’une source d’azote non préférentielle, TORC1 (target of rapamycin complex) est peu actif et la kinase Npr1 est hypophosphorylée et active. L’activation de Npr1 conduit à la phosphorylation d’Amu1 qui demeure cytosolique ce qui permet à Mep1 et Mep3 de rester actifs. Npr1 provoque aussi la phosphorylation de Mep2 au niveau d’un domaine C-terminal inhibiteur (-) de l’activité. Ce domaine étant inhibé, le domaine C-terminal activateur (+) de Mep2 peut activer le transport. En bas à gauche, E. coli : lors d’une suffisance en azote, l’α-cétoglutarate est consommé suite à l’assimilation de la source azotée et son niveau intracellulaire chute. La perte d’α-cétoglutarate lié à GlnK provoque l’hydrolyse de l’ATP, menant à un changement conformationnel de la boucle T qui devient plus rigide. Dans le même temps, GlnK est déuridylé par GlnD. Dans ces conditions, GlnK rejoint la surface cellulaire et inhibe l’activité d’AmtB en insérant sa longue boucle T dans le pore de celui-ci. En bas à droite, S. cerevisiae : en présence d’une source azotée préférentielle, TORC1 est activé, la kinase Npr1 est hyperphosphorylée et inactive. Amu1 est alors déphosphorylé et s’accumule à la surface cellulaire où il interagit physiquement avec Mep1 et Mep3, ce qui inhibe leur capacité à transporter l’ammonium. En outre, le domaine de régulation négative (-) de Mep2 n’est pas phosphorylé et est libre d’inhiber l’action du domaine de régulation positive (+), Mep2 est donc inactif. MP : membrane plasmique ; U : groupement uridyl ; P : groupement phosphate ; Amu1 : ammonium uptake 1 ; GlnD : bifunctional uridylyltransferase/uridylyl-removing enzyme ; Npr1 : nitrogen permease reactivator 1.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




