Figure 3.
Télécharger l'image originale
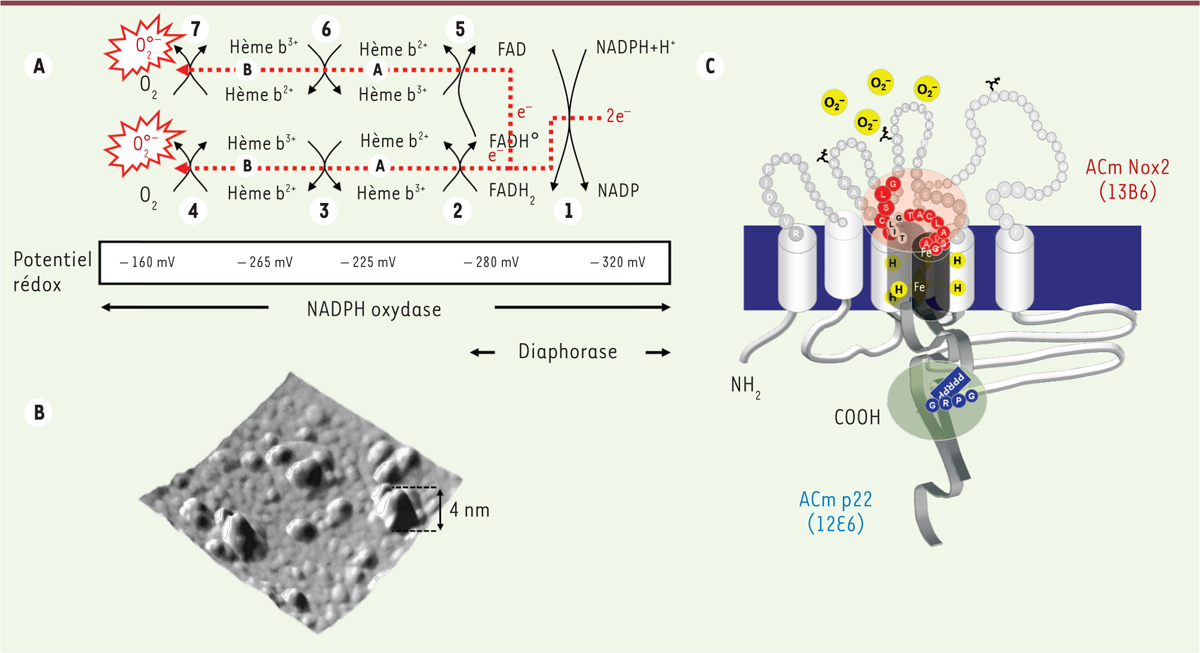
Structure et mécanisme de transfert d’électrons. A. Mécanisme de transfert d’électrons d’après [12, 44]. Nox2/gp91phox est supposé être organisé en dimère. Le transfert des deux électrons fournis par le NADPH (étape 1) s’effectue en sept étapes avec un transport du premier électron à partir du FADH2 (étapes 2, 3 et 4) pour former le premier O2• -. Le deuxième électron est transporté à la suite du premier à partir du radical FADH• (étapes 5, 6 et 7) pour générer le deuxième O2•-. L’activité diaphorase (étape 1) est portée par la portion cytosolique de la protéine. B. Image de microscopie à force atomique (AFM) montrant, en 3D, le complexe de la NADPH oxydase, reconstitué dans des liposomes après assemblage dans les neutrophiles stimulés. La hauteur estimée du complexe oxydase assemblé est de 4 nm [23]. C. Modèle d’organisation topologique de l’interaction entre les deux sous-unités du cytochrome b558, Nox2 et p22phox dans le complexe activé. La génération d’anticorps monoclonaux dirigés contre les deux sous-unités du cytochrome b558, Nox2 et p22phox, marquant préférentiellement le cytochrome b558 dans sa forme active, a permis, après détermination des épitopes reconnus par ces anticorps, de proposer un modèle d’activation du cytochrome b558 qui favoriserait un rapprochement spatial entre des régions extracellulaires de Nox2 (2e boucle extracellulaire, boucle C) et de p22phox (110GTACLAIAS118) (ACm 13B6) [26], et entre les parties cytosoliques des deux sous-unités (Nox2, 559GPR561 et p22phox, 155PPPRPP160) (ACm 12E6) [25].
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




