Figure 1.
Télécharger l'image originale
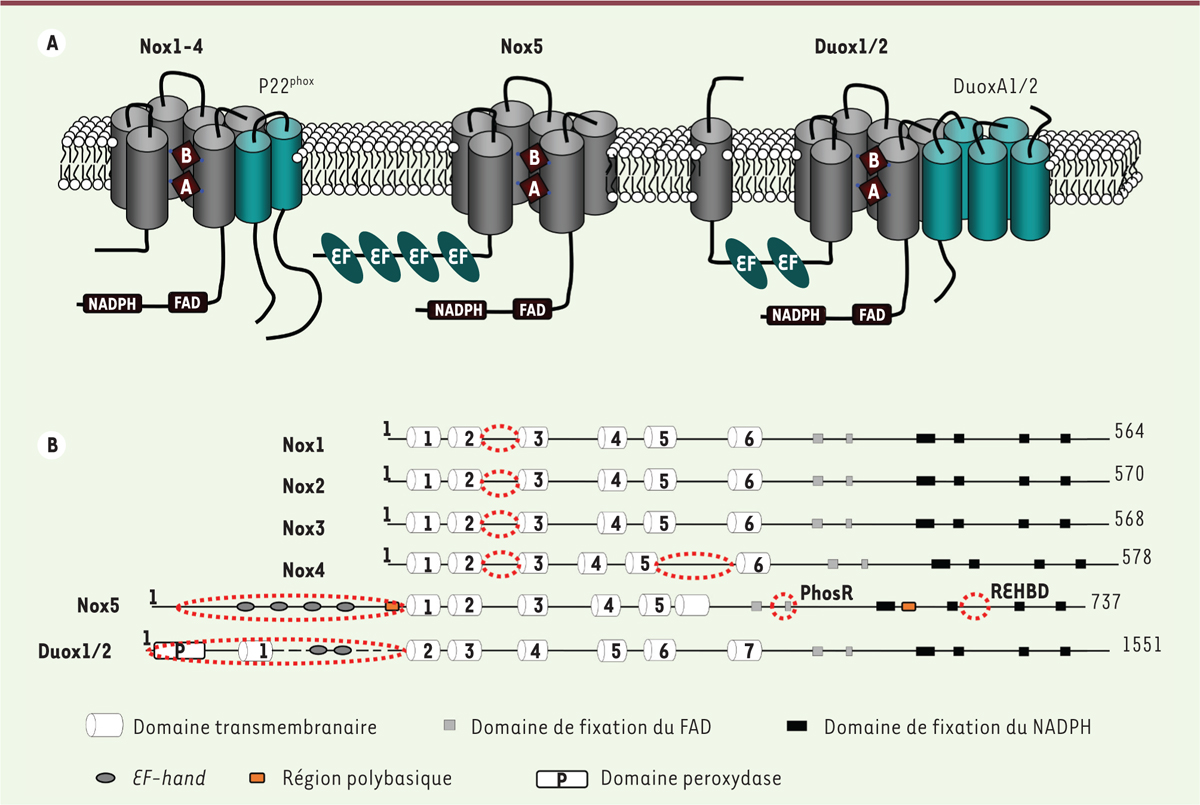
La famille des NADPH oxydases. A. Représentation schématique des Nox avec leurs partenaires au sein de la double couche phospholipidique membranaire. Sur un plan topologique, Nox2 est la mieux caractérisée : la topologie des autres isoformes est spéculative et prédite. Les Nox, à l’exception des Duox, possèdent deux domaines : l’un est transmembranaire avec six hélices α connectées par cinq boucles A, B, C, D et E ; l’autre, présent dans le cytoplasme, est le domaine déshydrogénase : c’est le domaine catalytique avec quatre sites de liaison du NADPH et deux sites de fixation du FAD. Tous les membres de la famille Nox chez l’homme possèdent le même noyau flavocytochrome ; c’est le domaine Nox qui correspond, non seulement aux régions transmembranaires, mais aussi à des sous-régions qui se replient pour former des cavités nécessaires à la liaison du FAD et du NADPH. Ce domaine Nox occupe environ 35 % de la séquence [5]. Nox5 renferme, en plus de ce domaine, en position amino-terminale, des motifs riches en EF-hand destinés à lier le calcium. Quant aux Duox, elles sont construites à partir de la structure de Nox5 avec, en position amino-terminale, un passage transmembranaire supplémentaire et une séquence homologue à celle des peroxydases. P22phox est une protéine transmembranaire. C’est le garant de la stabilité de l’hétérodimère Nox/p22phox, site d’ancrage des facteurs cytosoliques d’activation pour les isoformes Nox1, 2 et 3, et le partenaire de Nox4. Nox5 est une entité unique tandis que les Duox sont stabilisées par des activateurs, DuoxA1, dont il existe quatre variants d’épissage, et DuoxA2. Les DuoxA sont des facteurs de maturation qui jouent le rôle de protéines chaperonnes. Leur absence confine les Duox dans le réticulum endoplasmique [16]. B. Représentation linéaire, en domaines, de la séquence protéique des Nox. Les cercles discontinus soulignent les régions importantes impliquées dans la régulation de l’activité de chaque protéine : la boucle B conservée chez les Nox1, 2, 3 et 4 servirait d’interface entre les domaines transmembranaire et déshydrogénase. La nature des ROS produites par Nox4 dépendrait de ses propriétés structurales et, en particulier, de celles de la boucle E. Nox5 possède quatre séquences EF-hand, deux séquences polybasiques en positions amino- et carboxy- terminales, et deux sites consensus en position carboxy-terminale appelés REHBD (regulatory EF-hand binding domain) et PhosR, intervenant dans le repliement intramoléculaire de la protéine. Les Duox1/2 ont deux séquences EF-hand en position amino-terminale.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




