Figure 1.
Télécharger l'image originale
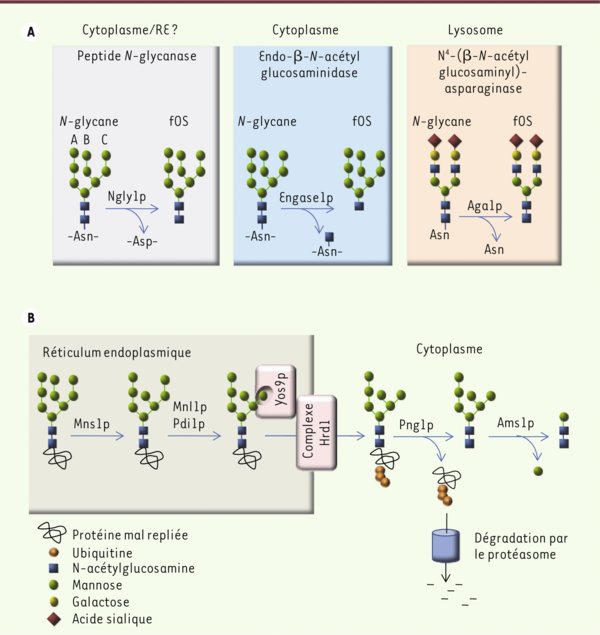
Les différentes enzymes capables de déglycosyler les N-glycosylprotéines et le rôle de la PNGase pendant le processus ERAD-L. A. Deux activités enzymatiques intracellulaires majeures sont capables de débrancher les chaînes N-glycanes en clivant la liaison entre le premier résidu de N-acétylglucosamine (GlcNAc) de l’oligosaccharide et l’asparagine (Asn) porteuse de la chaîne N-glycane. Au niveau du cytoplasme, une des activités de déglycosylation est portée par la peptide N-glycanase (PNGase), qui génère de façon concomitante un oligosaccharide libre (fOS) et la conversion du résidu Asn porteur de la chaîne N-glycane en résidu aspartate (Asp, panneau de gauche). Dans les lysosomes, une autre activité est portée par la N 4-(β-N-acétylglucosaminyl)-1-asparaginase qui ne peut agir que si la dégradation de la partie peptidique de la glycoprotéine a eu lieu au préalable (panneau de droite). Certaines données suggèrent également qu’il existerait une activité PNGase à l’intérieur même du réticulum endoplasmique (RE), mais bien que cette activité soit sensible à l’inhibiteur Z-VAD-fmk, la protéine responsable n’a pas encore été caractérisée [32, 33]. À ces activités de déglycosylation, il faut ajouter l’endo-β-N-acétylglucosaminidase cytosolique (ENGase) qui est également capable d’hydrolyser les chaînes N-liées en clivant la liaison entre les deux résidus de N-acétylglucosamine (GlcNAc) de l’oligosaccharide (panneau du milieu), et qui pourrait prendre le relais de la PNGase. B. Le processus ERAD est une machinerie moléculaire complexe ; elle permet de repérer les N-glycosylprotéines qui restent mal repliées après leur biosynthèse dans le RE, puis de les dégrader via le protéasome. Ce processus a été conservé au cours de l’évolution et les connaissances qui ont été établies à partir du modèle de la levure sont applicables aux eucaryotes supérieurs, avec toutefois un niveau de complexité plus élevé. Trois voies ERAD ont été décrites qui reconnaissent des domaines peptidiques mal repliés localisés, soit dans le cytosol (ERAD-C), soit dans la membrane (ERAD-M), soit dans la lumière du RE (ERAD-L). N’est représentée sur le schéma que la voie ERAD-L chez S. cerevisiae. Cette voie ERAD-L est la mieux connue et repose sur trois propriétés : la reconnaissance de la région peptidique, qui reste mal repliée, par l’apparition de régions hydrophobes accessibles ; la modification de la structure oligosaccharidique par l’action successive de différentes glycosidases (Mns1p [mannosidase réticulaire I] et le complexe Mnl1p/Htm1p-Pdi1p) ; et la reconnaissance de la structure oligosaccharidique Man7GlcNAc2 qui en résulte comme signal de dégradation. Cette structure comporte un résidu mannose en α1,6, démasqué sur la branche C de l’oligosaccharide et qui est reconnu spécifiquement par la lectine Yos9p/Os9p. Des complexes transmembranaires protéiques organisés autour de différentes E3 ubiquitine ligases (Hrd1p, Hrd3p, et Der1p) jouent un rôle stratégique, car ils coordonnent les différents évènements qui ont lieu de part et d’autre de la membrane du RE, tels que l’ubiquitination des N-glycosylprotéines mal repliées et leur rétrotranslocation vers le cytosol. Les substrats ubiquitinés sont alors déglycosylés par la PNGase cytosolique avant leur dégradation par le protéasome [22]. Les fOS, qui sont issus de l’hydrolyse des chaînes N-glycanes, sont eux-mêmes soumis à une voie métabolique : chez la levure, ils sont démannosylés de façon progressive par une mannosidase cytosolique codée par le gène Ams1 jusqu’à la structure ne comportant plus que deux résidus de GlcNAc et un résidu de mannose [23].
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




