Figure 3.
Télécharger l'image originale
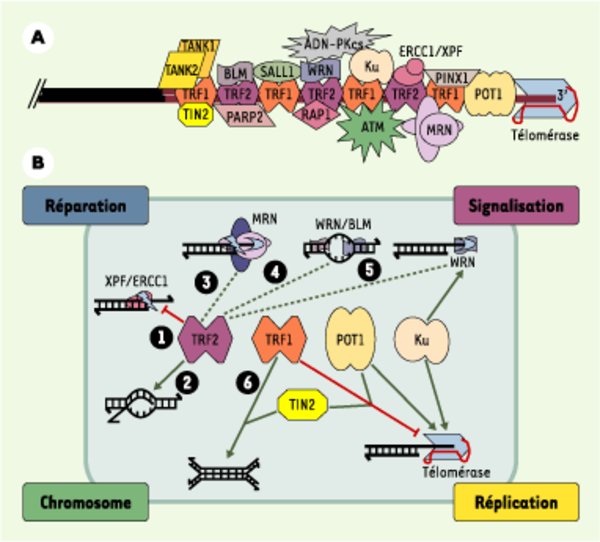
Organisation et activités des télomères humains. A. Interactions connues acide nucléique-protéine et protéine-protéine au niveau d’un télomère humain. Les répétitions d’ADN télomérique (TTAGGG) sont représentées par des lignes rouges ; la position relative des protéines le long de l’ADN télomérique est arbitraire, à l’exception des protéines POT1 connues pour interagir avec l’ADN 3’ sortant. B. Les protéines TRF1, TRF2 et POT1 sont engagées dans des interactions qui règlent plusieurs types d’activités concernant la structure de l’ADN télomérique (nucléase, hélicase, polymérase, recombinase, chaperon…). Ainsi, en inactivant XPF1/XRCC1, TRF2 préserve l’intégrité de l’ADN 3’ sortant (1). La protéine TRF2 est également impliquée dans la formation de boucles télomériques (t-loop) par une activité chaperon catalysant l’invasion de l’extrémité 3’ sortante dans le duplexe (2) [29]. TRF2 interagit avec d’autres enzymes jouant un rôle important dans la conformation et la maturation de L’ADN télomérique : le complexe MRN, qui se comporte in vitro comme une endonucléase et une exonucléase 3’->5’ (3), les protéines WRN et BLM, qui sont des hélicases (4), dont l’activité peut être couplée, dans le cas de WRN, à une activité exonucléase (5). On ne sait pas encore si l’interaction avec TRF2 active ou inhibe les activités 3 à 5 (trait pointillé), mais il est clair que l’ensemble des activités contrôlées par TRF2 joue un rôle clé dans la structure et la conformation de l’ADN télomérique 3’ sortant. De son côté, TRF1 interagit avec de nombreuses protéines capables de moduler l’activité de la télomérase. C’est le cas des protéines TIN2 et POT1 ; ces interactions peuvent expliquer pourquoi le surdosage de TRF1 entraîne une diminution de la taille des télomères. Il a été également décrit que TRF1 favoriserait l’association de deux duplexes d’ADN télomériques (6), pouvant ainsi contribuer à la formation des t-loop ou à celle des associations intertélomériques dans le noyau interphasique. Il devient donc primordial d’élaborer des modèles intégrant ces différentes activités aux grandes fonctions cellulaires dans lesquelles interviennent les télomères (réparation, signalisation, structure des chromosomes et réplication). Cette intégration est certainement complexe, car il semble que les fonctions cellulaires des télomères dépendent de plusieurs activités, et qu’une activité puisse être impliquée dans différentes fonctions. Par exemple, la capacité de TRF2 de contrôler l’activité de XPF/ERCC1 (1) peut expliquer à la fois comment les télomères empêchent la ligature non homologue entre deux télomères, par la voie de réparation des cassures double-brin (appelée NHEJ, non-homologous end-joining), et comment l’ADN 3’ sortant est maintenu pour servir de substrat à la télomérase.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




