Figure 2.
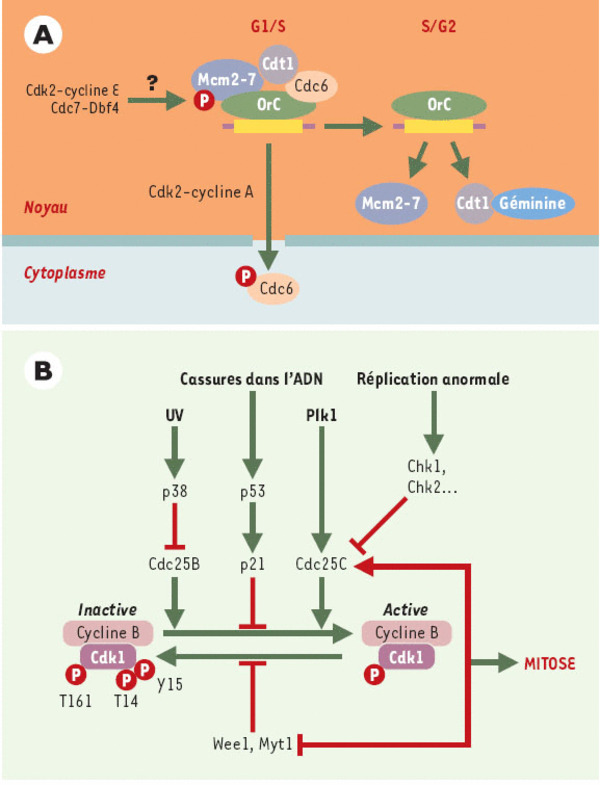
Contrôle des transitions G1/S et G2/M. A. Les origines de réplication (rectangles jaunes) fixent pendant la phase G1 le complexe hexamérique ORC (origin recognition complex), qui sert à son tour de plate-forme sur laquelle viennent se loger, de façon séquentielle, Cdc6, Cdt1, le complexe hexamérique MCM (mini-chromosome maintenance) (hélicase ?), et les facteurs requis pour le démarrage proprement dit de la réplication: Cdc45, RFA (replication factor A) et l’ADN polymérase α [56, 57]. L’assemblage et l’activation d’un tel complexe sont sous la dépendance, d’une façon qui n’est pas encore claire, des kinases Cdk2-cycline E et Cdc7-Dbf4. Les protéines Cdc6 et Cdt1 joueraient un rôle essentiel en recrutant ces facteurs afin de constituer le complexe de pré-initiation. Quand la réplication est enclenchée, Cdc6 et Cdt1 se détachent de la chromatine, à la suite d’une phosphorylation de Cdc6, vraisemblablement par Cdk2-cycline A. Cdc6 phosphorylé est exporté vers le cytoplasme. Quant à Cdt1, il est probablement inactivé par interaction avec la géminine. La reconstitution d’un complexe de préinitiation sur les origines qui ont été activées est ainsi évitée, et il ne peut, de ce fait, y avoir à nouveau réplication. Par ailleurs, sont également associées (mais non montrées sur ce schéma) des protéines de surveillance comme ATR (voir plus loin) qui vont arrêter la réplication en cas d’apparition de défauts au niveau de la fourche de réplication. B. Le complexe Cdk1/cycline B se forme à la suite de la synthèse de la cycline B en fin de phase S et de sa translocation depuis le cytoplasme (phases S et G2) vers le noyau (début de mitose). Son activité est contrôlée par une série de phosphorylations antagonistes. À la phosphorylation activatrice par la CAK (Cdk activating kinase) sur la thréonine 161 (boucle T, module l’interaction avec la cycline), s’opposent les phosphorylations inhibitrices sur la thréonine 14 et la tyrosine 15 (site de liaison de l’ATP) par les kinases Wee1 et Myt1 ([46] et Y. Pommier et K.W. Kohn, p.173 de ce numéro). La mutation de ces deux derniers acides aminés produit une entrée prématurée en mitose. Les résidus sérine 14 et tyrosine 15 sont déphosphorylés par les phosphatases Cdc25B et Cdc25C. L’activité et la localisation de ces phosphatases seraient également soumises à régulation, après phosphorylation par les kinases p38 pour Cdc25B, et Chk1 et Chk2 pour Cdc25C. Cette dernière, nucléaire juste avant la mitose, serait maintenue dans le cytoplasme à l’interphase, en raison de son interaction avec une protéine 14-3-3, après sa phosphorylation sur la sérine 216 par Chk1 et Chk2. Cdc25B contient plusieurs sites de fixation des protéines 14-3-3, dont la sérine 309, qui serait ciblée par la kinase de stress p38 en présence de lésions induites par les rayonnements ultraviolets [58]. Plk1 (Polo-like kinase) interviendrait également en amont et participerait à l’activation de Cdc25c. Quant aux autres phosphatases, elles doivent pour l’essentiel être caractérisées, PP2A supprimant vraisemblablement les phosphorylations apportées par les Cdk. La présence de lésions dans l’ADN active également une autre voie qui aboutit à l’inhibition de l’activité du complexe Cdk1-cycline B: l’induction de l’inhibiteur p21 par p53.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




