Figure 5.
Télécharger l'image originale
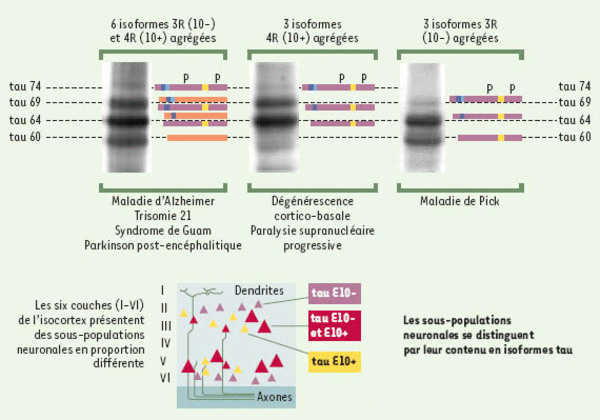
Caractérisation du profil électrophorétique des protéines tau anormalement phosphorylées dans les tauopathies. Les six variants anormalement phosphorylés de protéines tau qui forment majoritairement un triplet dans la maladie d’Alzheimer sont également détectés dans la trisomie 21, le syndrome de l’île de Guam et le syndrome parkinsonien post-encéphalitique. Au contraire, dans la paralysie supranucléaire progressive et la dégénérescence corticobasale, seules les isoformes de protéines tau anormalement phosphorylées à quatre domaines de liaison aux microtubules, s’agrègent et sont visualisées par immuno-empreintes comme un doublet majeur à 64 et 69 kDa avec une bande mineure à 74 kDa. Dans la maladie de Pick, les isoformes hyperphosphorylées à trois domaines de liaison aux microtubules s’agrègent en filaments et forment un doublet de 60 et 64 kDa avec un variant mineur de 69 kDa. Sur un schéma du cortex cérébral, il existe six couches dans l’isocortex. La distribution laminaire et régionale des lésions neuropathologiques d’agrégats de protéines tau (dégénérescence neurofibrillaire et corps de Pick) est différente pour une tauopathie donnée car les sous-populations neuronales qui dégénérent sont différentes. Ainsi, les différents profils électrophorétiques seraient liés à la dégénérescence de sous-populations neuronales différentes possédant un pool spécifique d’isoformes de protéines tau (E10+ : avec l’exon 10. E10- : sans l’exon 10 [5, 9, 16]).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




