Figure 4.
Télécharger l'image originale
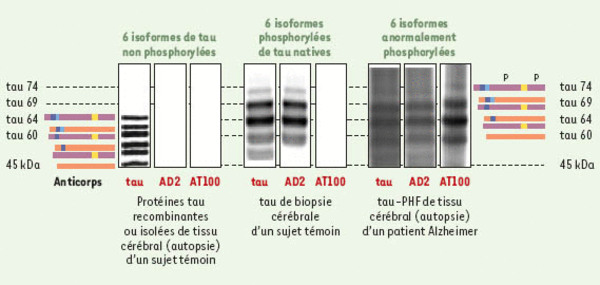
Isoformes des protéines tau et mobilité électrophorétique : influence de la phosphorylation. Il est possible de visualiser les isoformes non phosphorylées, phosphorylées et anormalement phosphorylées de protéines tau par immuno-empreintes en utilisant les anticorps décrits dans les Figures 2 et 3. Les protéines tau non phosphorylées (par exemple, des protéines tau recombinantes) ne sont pas détectées avec des anti-tau dépendant de la phosphorylation (AD2 et AT100). Seul un anti-Tau indépendant de la phosphorylation (tau) permet de les visualiser avec une masse moléculaire apparente de 45 à 65 kDa. La phosphorylation normale des isoformes de protéines tau conduit à un ralentissement de leur mobilité électrophorétique qui se caractérise par une masse moléculaire apparente plus élevée de 60 à 74 kDa. Ces variants phosphorylés forment un triplet majeur de 60, 64 et 69 kDa avec un variant mineur à 74 kDa. Ils sont reconnus par un anticorps anti-tau et des anticorps anti-tau dépendant de la phosphorylation (AD2). En revanche, des anticorps spécifiques de la phosphorylation anormale (AT100) ne reconnaissent pas ces variants phosphorylés. Comme les variants normalement phosphorylés, les six variants de tau anormalement phosphorylés extraits de PHF (tau-PHF) apparaissent par immuno-empreintes sous la forme d’un triplet de 60, 64 et 69 kDa et d’une bande mineure à 74 kDa, et sont détectables par des sondes immunologiques spécifiques (AT100). Ils sont également reconnus par les autres anticorps (AD2 et tau).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




