Figure 2.
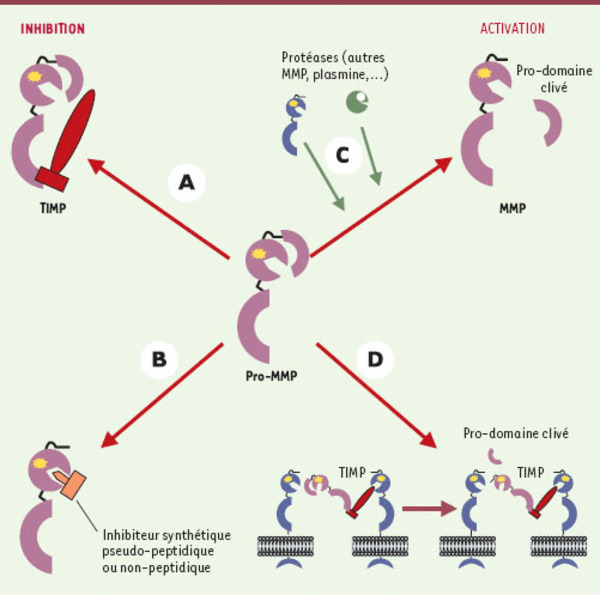
Mécanismes de régulation de l’activité des MMP. Les MMP sont inhibées par la formation d’un complexe équimolaire avec le TIMP (A) ou par des inhibiteurs synthétiques pseudo-peptidiques ou non-peptidiques qui entrent en compétition au niveau du site catalytique avec le substrat naturel (B). Les MMP sont aussi sécrétées sous forme de pro-enzyme et doivent être activées par clivage protéolytique du pro-domaine. Ce clivage se produit soit dans le milieu extracellulaire par l’action d’une autre MMP ou de la plasmine (C), soit à la surface cellulaire comme c’est le cas pour la pro-MMP2 (violet) qui est activée par la MT1-MMP (bleu) à laquelle elle se lie après avoir formé un complexe avec le TIMP-2 (rouge) (D).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




