| Issue |
Med Sci (Paris)
Volume 17, Number 12, Décembre 2001
|
|
|---|---|---|
| Page(s) | 1333 - 1335 | |
| Section | Nouvelles et Brèves | |
| DOI | https://doi.org/10.1051/medsci/200117121333 | |
| Published online | 15 December 2001 | |
Un modèle transgénique pour la listériose humaine : rôle de l’interaction entre l’internaline et la E-cadhérine dans la traversée de la barrière intestinale par L. monocytogenes
Unité des Interactions, Bactéries-Cellules, Institut Pasteur, 28, rue du Docteur-Roux, 75724 Paris Cedex 15, France
Listeria monocytogenes est la bactérie responsable de la listériose humaine, une infection d’origine alimentaire touchant préférentiellement les sujets aux ages extrêmes de la vie, les femmes enceintes, et les patients immunodéprimés [1]. La gravité de la listériose humaine tient à la capacité qu’a cette bactérie intracellulaire facultative d’atteindre le système nerveux central et l’unité fœto-placentaire. Au cours du processus infectieux, L. monocytogenes peut donc franchir trois barrières : la barrière intestinale, porte d’entrée dans l’organisme, la barrière hémato-encéphalique au cours des atteintes neuroméningées, et la barrière maternofoetale, au cours des infections foeto-placentaires. Jusqu’à ce jour, les déterminants moléculaires du franchissement de ces barrières n’étaient pas connus.
Le modèle animal le plus couramment utilisé pour étudier la listériose humaine est le modèle murin. Dans ce modèle, une infection par voie intraveineuse peut entraîner une létalité, et la dose létale tuant 50 % des animaux (DL 50) est d’environ 105 bactéries. Ce modèle a été particulièrement utile aux immunologistes, puisqu’il a permis de découvrir les bases de l’immunité cellulaire [2]. Cependant, il a de longue date été remarqué que, dans cette espèce, l’infection par voie orale est très peu efficace, qu’elle n’entraîne pas de mortalité reproductible, et que la translocation de L. monocytogenes au travers de la barrière intestinale est particulièrement faible, non supérieure à celle de L. innocua, une espèce de Listeria non invasive non pathogène. De plus, chez la souris, contrairement à ce qui est observé dans l’espèce humaine, L. monocytogenes ne semble pas présenter un tropisme électif pour le système nerveux central et l’unité foetoplacentaire.
L’entrée de L. monocytogenes dans les cellules en culture
Les mécanismes de l’infection cellulaire par L. monocytogenes ont été étudiés en détails, et la mise au point d’outils de mutagenèse a permis d’identifier les principaux effecteurs bactériens responsables des différentes étapes du processus infectieux (figure 1) [3]. Il a ainsi été démontré que l’internaline (InlA) et InlB, deux protéines de surface de L. monocytogenes, sont chacune suffisante pour permettre l’internalisation de L. monocytogenes dans les cellules non phagocytaires [4–7]. L’internaline est nécessaire et suffisante pour permettre l’internalisation dans les cellules épithéliales humaines exprimant son récepteur la E-cadhérine, telles que les cellules Caco-2 [8]. InlB permet l’entrée dans un très grand nombre de cellules, qu’elles expriment ou non la E-cadhérine. InlB a deux récepteurs connus, dont l’expression est quasi ubiquitaire, le gC1q-R (récepteur de la partie globulaire du composé C1q de la cascade du complément) et c-Met (récepteur du facteur de croissance des hépatocytes ou HGF) [9, 10].
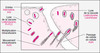 |
Figure 1. Les différentes phases de l’infection cellulaire par Listeria monocytogenes. Les effecteurs bactériens qui en sont reponsables sont indiqués en rouge. |
Spécificité de l’interaction de l’internaline avec son récepteur la E-cadhérine
L’interaction de l’internaline avec la E-cadhérine est très spécifique [11]. En effet, contrairement à la E-cadhérine humaine, la E-cadhérine murine n’est pas un récepteur pour l’internaline, malgré une identité de 85 % entre ces deux protéines. Pour élucider les bases moléculaires de cette spécificité, nous avons produit une série de protéines hybrides et avons ainsi pu démontrer que la région responsable de la spécificité était le premier des cinq domaines extra cellulaires de la E-cadhérine [11]. Par mutagenèse dirigée, nous avons ensuite pu démontrer que la spécificité tenait à la nature d’un seul acide aminé, le seizième, qui est un acide glutamique dans la E-cadhérine murine non reconnue par l’internaline, et une proline dans la E-cadhérine humaine reconnue par l’internaline [11]. Ces résultats expliquent qu’aucun rôle de l’internaline n’ait pu être mis en évidence dans le modèle murin, qui s’avère a posteriori inapproprié pour déterminer le rôle de cette interaction in vivo. En revanche, le cobaye, dont la E-cadhérine porte une proline en position 16 et est reconnue par l’internaline in vitro, semble constituer un modèle adéquat pour étudier le rôle de cette protéine [11].
Rôle de l’interaction entre l’internaline et la E-cadhérine in vivo
Nous avons donc étudié dans cette espèce animale le rôle de l’internaline. Contrairement à ce qui est observé chez la souris (ainsi que chez le rat, dont la E-cadhérine comporte aussi un acide glutamique en position 16 et n’est donc pas reconnu par l’internaline), il existe une mortalité dose-dépendante et internaline-dépendante après infection par voie orale chez le cobaye [12]. Dès 9 heures après l’administration de l’inoculum, L. monocytogenes peut être détectée dans les entérocytes de l’intestin grêle. Vingt-quatre heures après l’infection, des sites de réplication bactérienne entraînant un afflux de polynucléaires et de monocytes sont présents dans la lamina propria des villosités intestinales. Les bactéries gagnent ensuite les ganglions mésentériques, le foie et la rate. Ainsi, dans ce modèle où l’interaction internaline-E-cadhérine peut avoir lieu, l’internaline permet la traversée de la barrière intestinale, et l’infection du tissu intestinal puis des organes profonds [12] (figure 2).
 |
Figure 2. Conséquences in vitro et in vivo de la spécificité de l’interaction entre l’internaline et la E-cadhérine. À gauche : Différentes phases de l’infection in vivo. À droite: Conséquences sur l’entrée de Listeria monocytogenes dans les cellules de la spécificité de l’interaction entre l’internaline et la E-cadhérine. |
A ce stade, si nous avions démontré que l’internaline est un facteur de virulence de L. monocytogenes associé à une mortalité dose-dépendante, il restait à démontrer que l’effet de l’internaline était la conséquence de son interaction avec la E-cadhérine, et à déterminer la cellule cible exprimant la E-cadhérine reconnue par l’internaline in vivo. Ayant constaté la présence de L. monocytogenes intraentérocytaires chez le cobaye, notre première hypothèse était que l’internaline interagissait avec la E-cadhérine exprimée à la surface des entérocytes. Il était cependant possible que la présence de ces bactéries intraentérocytaires témoigne d’un passage des bactéries de cellule en cellule, plutôt que d’une infection directe des entérocytes (comme cela a notamment été décrit pour Shigella). En effet, la E-cadhérine est aussi exprimée dans d’autres cellules du tissu intestinal, comme les cellules M ou les cellules dendritiques des plaques de Peyer.
Pour démontrer le rôle de la E-cadhérine entérocytaire dans la listériose acquise par voir orale, nous avons construit, en collaboration avec l’équipe de Charles Babinet (Unité de biologie du Développement, Institut Pasteur, Paris) une lignée de souris transgénique exprimant la E-cadhérine humaine de façon restreinte aux entérocytes, en plaçant l’ADNc de la E-cadhérine humaine sous le contrôle du promoteur du gène iFABP, qui est exclusivement exprimé dans les entérocytes [12]. Dans ce modèle transgénique, L. monocytogenes acquiert la capacité de traverser la barrière intestinale pour atteindre les ganglions mésentériques, le foie et la rate, et provoquer une infection létale. Ces résultats démontrent formellement le rôle crucial de l’interaction internaline-E-cadhérine au niveau entérocytaire dans la traversée de la barrière intestinale et le développement d’une infection invasive après inoculation par voie orale [12] (cf. figure 2).
Conclusions et perspectives
L’interaction entre l’internaline de L. monocytogenes et la E-cadhérine entérocytaire est donc une étape clef de la listériose. Ces résultats apportent une explication moléculaire aux résultats d’études épidémiologiques récentes ayant démontré l’entéropathogénicité de L. monocytogenes chez l’homme [13, 14]. L’obtention de ce modèle transgénique de listériose acquise par voie orale permet d’envisager d’étudier de nouveaux aspects de la listériose, notamment d’identifier des facteurs de l’hôte impliqués dans la sensibilité ou la résistance à cette infection. Il est en effet possible de croiser notre lignée transgénique avec différentes autres lignées invalidées pour des gènes codant pour des effecteurs du système immunitaire et d’ainsi disposer d’un outil génétique pour étudier leur fonction au cours de la listériose acquise par voie orale. Les bases moléculaires de la traversée par L. monocytogenes des barrières hémato-encéphalique et maternofoetale au cours de la listériose humaine sont inconnues (cf. figure 2). Ces barrières comportent des cellules exprimant la E-cadhérine (cellules épithéliales des plexus choroïdes, cellules endothéliales des microvaissaux cérébraux, cytotrophoblaste et cellules épithéliales amniotiques). Ces cellules pourraient donc constituer une cible pour L. monocytogenes. Nous étudions donc actuellement le rôle de l’interaction internaline-E-cadhérine dans la traversée de ces deux barrières.
Ces résultats illustrent combien une approche moléculaire in vitro apparemment initialement réductionniste peut contribuer à l’élaboration d’un modèle animal approprié pour étudier une maladie humaine. Ils illustrent la puissance de la transgenèse pour établir des modèles animaux de maladies humaines bactériennes, d’une façon comparable à ce qui a été précédemment décrit pour des maladies virales spécifiquement humaines [15, 16].
Références
- Lorber B. Listeriosis. Clin Infect Dis 1997; 24 : 1–9. [Google Scholar]
- Mackaness GB. Cellular resistance to infection. J Exp Med 1962; 118 : 381–406. [Google Scholar]
- Cossart P, Lecuit M. Interactions of Listeria monocytogenes with mammalian cells during entry and actin-based movement : bacterial factors, cellular ligands and signaling. EMBO J 1998; 17 : 3797–806. [Google Scholar]
- Gaillard JL, Berche P, Frehel C, Gouin E, Cossart P. Entry of L. monocytogenes into cells is mediated by internalin, a repeat protein reminiscent of surface antigens from gram-positive cocci. Cell 1991; 65 : 1127–41. [Google Scholar]
- Dramsi S, Biswas I, Maguin E, Braun L, Mastroeni P, Cossart P. Entry of Listeria monocytogenes into hepatocytes requires expression of inIB, a surface protein of the internalin multigene family. Mol Microbiol 1995; 16 : 251–61. [Google Scholar]
- Braun L, Ohayon H, Cossart P. The InIB protein of Listeria monocytogenes is sufficient to promote entry into mammalian cells. Mol Microbiol 1998; 27 : 1077–87. [Google Scholar]
- Lecuit M, Ohayon H, Braun L, Mengaud J, Cossart P. Internalin of Listeria monocytogenes with an intact leucine-rich repeat region is sufficient to promote internalization. Infect Immun 1997; 65 : 5309–19. [Google Scholar]
- Mengaud J, Ohayon H, Gounon P, Mege RM, Cossart P. E-cadherin is the receptor for internalin, a surface protein required for entry of L. monocytogenes into epithelial cells. Cell 1996; 84 : 923–32. [Google Scholar]
- Braun L, Ghebrehiwet B, Cossart P. gC1q-R/p32, a C1q-binding protein, is a receptor for the InlB invasion protein of Listeria monocytogenes. EMBO J 2000; 19: 1458–66. [Google Scholar]
- Shen Y, Naujokas M, Park M, Ireton K. InIBdependent internalization of Listeria is mediated by the Met receptor tyrosine kinase. Cell 2000; 103: 501–10. [Google Scholar]
- Lecuit M, Dramsi S, Gottardi C, Fedor-Chaiken M, Gumbiner M, Cossart P. A single amino acid in E-cadherin responsible for host specificity towards the human pathogen Listeria monocytogenes. EMBO J 1999; 18: 3956–63. [Google Scholar]
- Lecuit M, Vandormael-Pournin S, Lefort J, et al. A transgenic model for listeriosis : role of internalin in crossing the intestinal barrier. Science 2001; 292 : 1722–5. [Google Scholar]
- Dalton CB, Austin CC, Sobel J, et al. An outbreak of gastroenteritis and fever due to Listeria monocytogenes in milk. N Engl J Med 1997; 336 : 100–5. [Google Scholar]
- Aureli P, Fiorucci GC, Caroli D, et al. An outbreak of febrile gastroenteritis associated with corn contaminated by Listeria monocytogenes. N Engl J Med 2000; 342 : 1236–41. [Google Scholar]
- Ren RB, Costantini F, Gorgacz EJ, Lee JJ, Racaniello VR. Transgenic mice expressing a human poliovirus receptor : a new model for poliomyelitis. Cell 1990; 63 : 353–62. [Google Scholar]
- Oldstone MB, Lewicki H, Thomas D, et al. Measles virus infection in a transgenic model : virus-induced immunosuppression and central nervous system disease. Cell 1999; 98 : 629–40. [Google Scholar]
© 2001 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Les différentes phases de l’infection cellulaire par Listeria monocytogenes. Les effecteurs bactériens qui en sont reponsables sont indiqués en rouge. |
| Dans le texte | |
 |
Figure 2. Conséquences in vitro et in vivo de la spécificité de l’interaction entre l’internaline et la E-cadhérine. À gauche : Différentes phases de l’infection in vivo. À droite: Conséquences sur l’entrée de Listeria monocytogenes dans les cellules de la spécificité de l’interaction entre l’internaline et la E-cadhérine. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




