| Numéro |
Med Sci (Paris)
Volume 17, Numéro 12, Décembre 2001
|
|
|---|---|---|
| Page(s) | 1327 - 1329 | |
| Section | Nouvelles et Brèves | |
| DOI | https://doi.org/10.1051/medsci/200117121327 | |
| Publié en ligne | 15 décembre 2001 | |
Les multiples rôles de l’ubiquitinylation des protéines
Inserm U. 526, Faculté de médecine Pasteur, avenue de Valombrose, 06107 Nice Cedex 02, France
Les réactions d’ubiquitinylation représentent une modification covalente post-traductionnelle des protéines, et changent les propriétés des protéines cibles et leur destin cellulaire comme le fait la phosphorylation. L’ubiquitinylation est d’abord et surtout connue pour son rôle dans le guidage des protéines vers une voie de dégradation, mais plusieurs études récemment publiées lui attribuent de nouvelles fonctions inattendues.
L’ubiquitine est une protéine de 76 acides aminés, couplée aux protéines à la suite de l’action concertée de trois enzymes. E1 (ubiquitin-activating enzyme, UBC) active l’ubiquitine en présence d’ATP, pour former une liaison thioester de haute énergie sur la glycine amino-terminale de l’ubiquitine. L’ubiquitine est ensuite transférée à une protéine E2 (ubiquitin-conjugating enzyme) chargée de sa conjugaison sur un groupe ε-NH2 d’une lysine de la protéine cible, en coordination avec une protéine E3 (ubiquitin protein-ligase) qui contrôle la spécificité du système en reconnaissant la cible. Il existe dans la cellule plusieurs E2 (E2a, E2b, E2c) et la famille des enzymes E3 ne cesse de s’agrandir. La reconnaissance du substrat peut être directe par la séquence primaire de la cible, ou induite après phosphorylation de la cible ou interaction de la cible avec une molécule chaperon. Une chaîne de poly-ubiquitinylation est réalisée par l’addition successive de molécules d’ubiquitine sur la lysine 48 de l’ubiquitine précédente dans la chaîne. La protéine poly-ubiquitinylée est ensuite dégradée par le protéasome, l’ubiquitine libérée étant recyclée (pour revue, voir [1, 2]).
L’ubiquitinylation est une étape importante de la voie d’activation des facteurs de transcription de la famille NF-κB (m/s 1999, n°3, p.419). Dans le cytoplasme, NF-κB est maintenu inactif par une sous-unité inhibitrice IκB, et c’est une réaction d’ubiquitinylation qui conduit à l’activation de NF-κB via la dégradation de l’inhibiteur IκB. Dans une première étape, l’engagement de nombreux récepteurs de surface comme les récepteurs du TNF (tumor necrosis factor) ou de l’IL-1 (interleukine-1) ou la production de différents stress cellulaires (drogues, radiations, radicaux libres) [3] activent un complexe multi-protéique comprenant deux sérine kinases spécifiques d’IκB (IKKα, IKKβ) [4] qui phosphorylent les sérines 32 et 36 en amino-terminal de IκB. Puis, une enzyme E3: βTrCP ou E3RSIκB, de la famille SCF (Skp-1-cullin-Fbox/WD repeat) (m/s 1999, n°8-9 p.1008), reconnaît IκB phosphorylé sur les deux sérines et attire ensuite, via son domaine Fbox, la sous-unité Skp1. Cette dernière sert d’adaptateur pour les protéines Cullin-1 et ROC1 qui recrutent l’enzyme E2 (UBC5: ubiquitin conjugating enzyme). L’ubiquitinylation s’effectue sur les lysines 21 et 22 de IκB, entraînant sa dégradation par le protéasome et libérant NF-κB qui peut alors gagner le noyau [4–6] (figure 1). La séquence reconnue par E3RSIκB (DpSGXXpS) est retrouvée dans trois autres protéines: cactus, l’équivalent d’IκB chez la drosophile, la β-caténine et la protéine du VIH Vpu. Après ubiquitinylation, cactus, β-caténine et la molécule CD4 associée à Vpu sont dégradés.
Une nouvelle fonction de l’ubiquitinylation a été mise en évidence dans la voie d’activation de NF-κB par l’interleukine-1 (IL-1). Le récepteur de l’IL-1 utilise de nombreux adaptateurs, dont l’ubiquitine ligase (E3) TRAF6. TRAF6 interagit avec UBC13 (E2) et une protéine apparentée Uev1A (E1) qui catalysent sa polyubiquitinylation. De façon intéressante, les chaînes d’ubiquitine se fixent sur la lysine 63 de TRAF6 (et non plus la lysine 48) et sont indispensables à l’activation des IKK [10]. Dans ce modèle, l’inhibition pharmacologique du protéasome n’empêche pas l’activation des IKK, montrant que l’ubiquitinylation d’une protéine n’entraîne pas automatiquement sa dégradation mais peut, au contraire, l’activer. En effet, Ub-TRAF6 interagit avec, et active un complexe contenant la sérine kinase TAK1 et les adaptateurs TAB1 et TAB2. L’activation de TAK1 pourrait résulter d’un changement conformationnel, ou de l’interaction de TAK1 avec la chaîne d’ubiquitine portée par TRAF6. TAK1 agit ensuite directement sur les IKK pour activer la voie NF-κB et sur MKK6 pour activer la voie JNK [11] (figure 1).
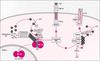 |
Figure 1. Deux aspects des fonctions de l’ubiquitinylation dans la voie d’activation de NF-κB. Dans la voie de signa-lisation par le TNF (tumor necrosis factor), l’ubiquitinylation de la sous-unité inhibitrice IκB, induite après activation du complexe IKK (IκB kinases) et phosphorylation de IκB, conduit à la dégradation de l’inhibiteur et à la libération de NF-κB actif. De façon différente et nouvelle, dans la voie de signalisation du récepteur de l’interleukine-1, l’ubiquitinylation de l’adaptateur TRAF6 est cruciale pour la stimulation de la kinase TAK1 qui va mobiliser la voie d’activation de NF-κB ainsi que la voie JNK. D’autres fonctions de l’ubiquitinylation sont discutées dans l’article. |
De façon différente, l’ubiquitinylation peut participer à la maturation d’une protéine. C’est le cas pour p105 et p100, les précurseurs de p50 (NF-κB1) et p52 (NF-κB2) de la famille NF-κB. P100 et p105 contiennent en carboxy-terminal une région auto-inhibitrice homologue à IκB. La phosphorylation puis l’ubiquitinylation conduisent à une dégradation partielle de p100 et de p105 qui élimine la région carboxy-terminale inhibitrice, donnant naissance aux facteurs de transcription mûrs p50, p52.
Troisième cible fonctionnelle de l’ubiquitinylation, l’interruption de voies de signalisation. Les récepteurs de facteurs de croissance à activité tyrosine kinase EGFR (récepteur de l’epidermal growth factor) et PDGFR (récepteur du platelet derived growth factor) sont dégradés après activation par l’intervention de l’enzyme E3 et du proto-oncogène c-Cbl. Par son domaine PTB, Cbl reconnaît les phosphotyrosines des récepteurs actifs et recrute une enzyme E2 par son domaine RING. L’ubiquitinylation scelle le sort du récepteur en le détournant vers une voie de dégradation, interrompant ainsi le signal mitogénique [8]. L’ubiquitine participe également au contrôle du cycle cellulaire dans lequel la destruction de certaines cyclines est requise pour la progression dans le cycle (cyclines A et B, inhibiteur p27) (pour revue, voir [9]).
L’ubiquitinylation intervient aussi pour dégrader de nombreux facteurs de transcription, mais il existe curieu-sement une corrélation entre ubiquitinylation et activation de la transcription. Dans un système hétérologue de mesure de la transcription chez la levure utilisant le facteur de transcription VP16 du virus VHS, une enzyme E3 spécifique de VP16 a été identifiée (Met30). L’ubiquitinylation du domaine de transactivation (TAD) de VP16 apparaît importante à la fois pour la dégradation de VP16 et l’activation de la transcription, bien que ces deux fonctions soient dissociables expérimentalement [12]. L’ubiquitinylation pourrait permettre le recrutement de cofacteurs indispensables [12] ou bien permettre le découplage de la polymérase II du complexe d’initiation sur les promoteurs et faciliter ainsi sa fonction d’élongation [13]. Ce mode de contrôle est peut-être opérationnel chez les eucaryotes aussi, et des facteurs comme Myc et Microphtalmia pourraient utiliser l’ubiquitinylation pour moduler leur activité transactivatrice [13].
Dernier exemple de l’intervention de l’ubiquitinylation dans les fonctions cellulaires : le couplage d’une seule ubiquitine sur certaines protéines adaptatrices (Nedd4, Rsp5) est un signal contrôlant de nombreuses étapes du trafic intracellulaire : endocytose, sélection dans le réseau transgolgien et même bourgeonnement viral (pour revue, voir [14]).
Ces différents exemples illustrent de multiples facettes fonctionnelles de l’ubiquitinylation. La conformation des chaînes d’ubiquitine ou le nombre de molécules d’ubiquitine fixées pourraient dicter la spécificité de ces réactions. Le degré de conservation particulièrement important de l’ubiquitine au cours de l’évolution, de la levure à l’homme, renforce l’idée qu’elle contrôle des fonctions cruciales de la cellule.
Références
- Ciechanover A. The ubiquitin-proteasome pathway : on protein death and cell life. EMBO J 1998; 17 : 7151–60. [Google Scholar]
- Laney JD, Hochstrasser M. Substrate targeting in the ubiquitin system. Cell 1999; 97 : 427–30. [Google Scholar]
- Pahl H. Activators and target genes of Rel/NF-κB transcription factors. Oncogene 1999; 18 : 6853–66. [Google Scholar]
- Karin M. How NF-kB is activated: the role of the IkB kinase (IKK) complex. Oncogene 1999; 18 : 6867–74. [Google Scholar]
- Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitinylation : the control of NF-[kappa]B activity. Annu Rev Immunol 2000; 18 : 621–63. [Google Scholar]
- Bottero V, Busuttil V, Frelin C, Imbert V, Peyron JF. Les facteurs de transcription NF kappa B : des mécanismes moléculaires d’activation à la régulation de la survie et de la prolifération cellu-laires. Regards sur la Biochimie 2001; 2 : 31–9. [Google Scholar]
- Palombella VJ, Rando OJ, Goldberg AL, Maniatis T. The ubiquitin-proteasome pathway is required for processing the NF-κB1 precursor protein and the activation of NF-κB. Cell 1994; 78 : 773–85. [Google Scholar]
- Joazeiro C, Wing S, Huang H, Leverson J, Hunter T, Liu Y. The tyrosine kinase negative regulator c-Cbl as a RING-type, E2-dependent ubiquitin-protein ligase. Science 1999; 286 : 223–5. [Google Scholar]
- Koepp D, Harper J, Elledge S. How the cyclin became a cyclin : regulated proteolysis in the cell cycle. Cell 1999; 97 : 431–4. [Google Scholar]
- Deng L, Wang C, Spencer E, et al. Activation of the IkB kinase complex by TRAF6 requires a dimeric Ubiquitin-conjugating enzyme complex and a unique polyubiquitin chain. Cell 2000; 103 : 351–61. [Google Scholar]
- Wang C, Deng L, Hong M, Akkaraju G, Inoue J, Chen Z. Tak1 is a ubiquitin-dependent kinase of MKK and IKK. Nature 2001; 412 : 346–51. [Google Scholar]
- Salghetti M, Caudy A, Chenoweth J, Tansey W. Regulation of transcriptional activation domain function by ubiquitin. Science 2001; 293 : 1651–3. [Google Scholar]
- Thomas D, Tyers M. Transcriptional regulation : kamikaze activators. Curr Biol 2000; 10 : 341–3. [Google Scholar]
- Hicke LA new ticket for entry into budding vesicles-ubiquitin. Cell 2001; 106 : 527–30. [Google Scholar]
© 2001 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Deux aspects des fonctions de l’ubiquitinylation dans la voie d’activation de NF-κB. Dans la voie de signa-lisation par le TNF (tumor necrosis factor), l’ubiquitinylation de la sous-unité inhibitrice IκB, induite après activation du complexe IKK (IκB kinases) et phosphorylation de IκB, conduit à la dégradation de l’inhibiteur et à la libération de NF-κB actif. De façon différente et nouvelle, dans la voie de signalisation du récepteur de l’interleukine-1, l’ubiquitinylation de l’adaptateur TRAF6 est cruciale pour la stimulation de la kinase TAK1 qui va mobiliser la voie d’activation de NF-κB ainsi que la voie JNK. D’autres fonctions de l’ubiquitinylation sont discutées dans l’article. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




