| Issue |
Med Sci (Paris)
Volume 17, Number 11, Novembre 2001
|
|
|---|---|---|
| Page(s) | 1214 - 1216 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/200117111214 | |
| Published online | 15 November 2001 | |
PP1 et PP2A, des sérine/thréonine phosphatases au cœur de l’apoptose
1
Laboratoire de signalisation immunoparasitaire, Institut Pasteur URA Cnrs 1960 Département d’immunologie, 25, rue du Dr-Roux, 75015 Paris, France
2
Laboratoire de physiologie de la reproduction Cnrs/Inra, 9, quai Saint-Bernard 75005 Paris France
3
Laboratoire de signalisation immunoparasitaire, Institut Pasteur URA Cnrs 1960 Département d’immunologie, 25, rue du Dr-Roux, 75015 Paris, France
4
Centro Nacional de Biotecnología, Department of Immunology and Oncology, Campus de Cantoblanco, UAM, 28049 Madrid, Espagne
L’étude des mécanismes qui contrôlent la survie et la mort cellulaire programmée, ou apoptose, permet une meilleure compréhension de notre développement et de certaines pathologies, infectieuses ou cancéreuses. Les protéine phosphatases sérine/thréonine de type 1 (PP1) et de type 2A (PP2A) ont été impliquées dans le contrôle de nombreux processus biologiques. Des travaux récents permettent de mieux appréhender une nouvelle fonction de ces enzymes : le contrôle de l’apoptose par la modification de l’activité des protéines de la famille Bcl-2.
Une vingtaine de protéines de cette famille ont été identifiées, certaines sont anti-apoptotiques (Bcl-2, Bcl-xL…), d’autres pro-apoptotiques (Bad, Bax, Bak…). On savait que l’équilibre entre les membres pro- et anti-apoptotiques suffit à déterminer la sensibilité de la cellule à l’apoptose, car ces protéines s’antagonisent mutuellement en formant des hétérodimères inactifs [1]. Plus récemment, il a été montré que des phosphorylations pouvaient aussi contrôler la fonction des protéines de la famille Bcl-2, et l’on a ainsi pu caractériser des voies de signalisation anti-apoptotiques activées par de nombreux facteurs de croissance qui impliquent la phosphatidyl inositol 3 kinase (PI3K), la kinase Akt (aussi appelée PKB ou RAC-PKB) ou des kinases activées en aval de la voie Ras. En particulier, il a été bien établi qu’en réponse à l’interleukine-3 (IL-3), une cytokine qui active la prolifération et inhibe l’apoptose de précurseurs de lignées hématopoïétiques, la phosphorylation de Bad sur des résidus sérine (112 et 136) permet son association avec les protéines chaperons de la famille 14-3-3. Cette association titre Bad et prévient son action pro-apoptotique [2].
Si la phosphorylation des protéines de la famille Bcl-2 peut modifier leur fonction, on pouvait aisément imaginer que des phosphatases soient aussi impliquées dans le contrôle de leur fonction.
PP1α, une nouvelle phosphatase contrôlée par Ras agissant sur Bad et Bcl-2
Les PP1 forment une famille de plusieurs holoenzymes d’expression ubiquiste. Elles sont produites par l’interaction spécifique de sous-unités catalytiques (dont il existe quatre isoformes α, β, γ1, γ2) et de sous-unités régulatrices qui sont impliquées dans le ciblage et la modulation de l’activité phosphatasique [3]. Dans une lignée lymphocytaire T murine, la lignée TS1 αβ, dont la survie dépend de l’IL-2 [4], le retrait de cette cytokine provoque l’arrêt de la prolifération et l’apoptose des cellules. Cet effet est associé à la déphosphorylation de Bad sur ses deux sérines 112 et 136. Le traite-ment par l’acide okadaïque, un inhibiteur des phosphatases PP1 et PP2A, bloque la déphosphorylation de Bad et prévient l’apoptose des cellules. En outre, seule PP1α (et non PP2A) interagit physiquement avec Bad, ce qui indique que PP1α est la phosphatase qui provoque la déphosphorylation de Bad [5] (figure 1).
 |
Figure 1. PP1, une nouvelle phosphatase qui contrôle la survie des cellules. Les facteurs de survie provoquent l’activation de la phosphatidylinositol-3 kinase (PI3K) et de la protéine kinase Akt. Cette dernière provoque notamment la phosphorylation de la sérine 136 de la protéine pro-apoptotique Bad. Il est bien établi que la phosphorylation des sérines 112 et 136 de Bad entraîne sa liaison avec la protéine cytosolique 14-3-3 ce qui inhibe sa fonction pro-apoptotique [2]. Dans une lignée de lymphocytes T, l’absence de cytokines provoque l’activation de la phosphatase PP1α qui provoque la déphosphorylation des deux sérines 112 et 116 de Bad, permettant son action apoptotique. Cette activité « Bad-phosphatase » est par ailleurs activée par Ras [5]. |
De façon beaucoup plus surprenante, différentes approches (double hybride dans le système levure, coimmunoprécipitations) nous ont permis de montrer que la phosphatase PP1α interagit aussi avec la protéine Bcl-2 [6]. Cette interaction s’effectue par l’intermédiaire d’une séquence qui contient un motif consensus du type R/K X V/I X F présent dans le site de liaison de nombreuses protéines régulatrices qui interagissent avec PP1α [7]. En fait, les trois protéines, Bad, Bcl-2 et PP1α forment un complexe qui possède une activité phosphatase, et peut ainsi être défini comme une nouvelle holoenzyme de PP1 que nous avons appelée «Bad phosphatase» [6]. En outre, Bcl-2 semble jouer le rôle de «sous-unité régulatrice» de PP1α : si l’on empêche son interaction avec PP1, on observe une diminution de la formation du complexe Bcl-2-Bad-PP1α, et une diminution de l’activité « Bad phosphatase». Enfin, si les cellules TS1αβ sont sevrées d’IL-2, l’activité «Bad phosphatase» liée à ce complexe augmente, un effet qui semble dû à l’activation de Ras [5]. On sait que les différentes isoformes des GTPases de la famille Ras sont impliquées dans le contrôle soit de la survie, soit de l’apoptose. Ces effets opposés de Ras sur la survie des cellules dépendent du type cellulaire, de l’isoforme impliquée, et des multiples voies de signalisation qui sont activées par Ras. Ainsi, dans la lignée lymphocytaire TS1αβ, Ras contrôle positivement la survie des cellules en présence d’IL-2 par l’intermédiaire de la voie de signalisation PI3K/Akt. Inversement, en l’absence de cytokines, Ras peut favoriser l’apoptose des cellules en inhibant, de façon indirecte, l’expression de Bcl-2 [8]. Il apparaît donc qu’une seconde voie par laquelle Ras promeut l’apoptose de ces cellules est l’activation de la «Bad phosphatase» PP1α, permettant ainsi la déphosphorylation de Bad. Enfin, il faut souligner que d’autres protéines anti-apoptotiques, notamment Bcl-xL ou Bcl-w, contiennent aussi le motif consensus d’interaction avec PP1α et pourraient donc, tout comme Bcl-2, être de nouvelles protéines de régulation de PP1α.
PP2A, une phosphatase qui contrôle Akt et Bcl-2
Plusieurs protéines impliquées dans la survie des cellules sont des substrats d’une autre sérine/thréonine protéine phosphatase, la phosphatase PP2A. Tout d’abord Akt, dont la déphosphorylation par PP2A inhibe l’activité, ce qui inactive la voie de signalisation anti-apoptotique dépendant de la PI3-K [9]. Mais aussi Bcl-2, dont on sait que la phosphorylation sur plusieurs résidus sérine, dont la Ser-70, contrôle de façon positive son activité anti-apoptotique [10, 11]. Or, PP2A peut s’associer de façon transitoire à Bcl-2, provoquer la déphosphorylation de la Ser-70, et inhiber sa fonction anti-apoptotique [12]. Enfin, la phosphatase PP1α elle même, dont l’activité est inhibée par la phosphorylation du résidu Thr 320 [13], pourrait être un troisième substrat de PP2A.
La possibilité que Bcl-2, PP1α et Bad s’associent pour former un complexe dont l’activité Bad phosphatase est accrue pendant l’apoptose permet d’envisager que cette activité phosphatase soit contrôlée positivement par PP2A, grâce à son interaction avec Bcl-2 et/ou PP1α (figure 2). PP2A se révélerait ainsi une enzyme clé dans le contrôle de l’apoptose en modulant l’activité de kinases comme Akt ou d’autres phosphatases comme PP1α/Bcl-2/Bad.
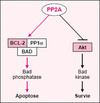 |
Figure 2. Modèle hypothétique de contrôle de l’apoptose par PP2A. Un des substrats de la phosphatase PP2A est la protéine-kinase Akt dont elle inhibe l’activité. De même, la déphosphorylation de Bcl-2 par PP2A inhibe son activité anti-apoptotique. En revanche, la phosphatase PP1α serait activable par PP2A. Le modèle présenté ici propose un rôle clé de PP2A dans l’apoptose, d’une part en inhibant l’activité Bad kinase d’Akt, et d’autre part en activant l’activité Bad phosphatase du complexe formé par les protéines Bad-Bcl-2-PP1α. Dans ce complexe, Bcl-2 semble jouer le rôle de sous-unité régulatrice de la phosphatase PP1α, et les cibles de PP2A pourraient être soit Bcl-2, soit PP1α, soit les deux. |
Remerciements
Nos travaux actuels, qui concernent l’étude des phosphatases et des protéines Bcl-2 dans les lymphocytes transformés par Theileria, sont financés par l’ARC (contrats 9449), ainsi que par l’Institut Pasteur (PTR n° 60) le Cnrs et l’INRA.
Références
- Oltvai ZN, Milliman CL, Korsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell 1993; 74 : 609–19. [Google Scholar]
- Zha J, Harada H, Yang E, Jocker J, Korsmeyer S. Serine phosphorylation of death agonist Bad in response to survival factor results in binding to 14-3-3 not Bcl-x. Cell 1996; 87 : 619–28. [Google Scholar]
- Hubbard MJ, Cohen P. On taget with new mechanism for the regulation of protein phosphorylation.Trends Biochem Sci 1993; 18 : 172–7. [Google Scholar]
- Pitton C, Rebollo A, Van Snick J, Theze J, Garcia A. High affinity and intermediate affinity forms of the IL-2R expressed in an IL-9-dependent murine T cell line deliver proliferative signals via differences in their transduction pathways. Cytokine 1993; 5 : 362–71. [Google Scholar]
- Ayllón V, Martinez AC, Garcia A, Cayla X, Rebollo A. Protein phophatase 1α is a Ras-activated Bad phosphatase that regulates IL-2 deprivation-induced apoptosis. EMBO J 2000; 19 : 2237–46. [Google Scholar]
- Ayllón V, Cayla X, Garcia A, et al. Bcl-2 targets protein phosphatase 1α to Bad. J Immunol 2001; 166 : 7345–52. [Google Scholar]
- Egloff MP, Johnson DJ, Moorhead G, Cohen PTW, Cohen P, Barford D. Structural basis for the recognition of regulatory subunits by the catalytic subunit of protein phosphatase 1. EMBO J 1997; 16 : 1876–87. [Google Scholar]
- Romero F, Martinez CM, Camonis J, Rebollo A. Aiolos transcription factor controls cell death in T cells by regulating Bcl-2 expression and its cellular localisation. EMBO J 1999; 18 : 3419–30. [Google Scholar]
- Millward TA, Zolnierowicz S, Hemmings BA. Regulation of protein kinase cascades by protein phosphatase 2A. Trends Biochem Sci 1999; 24 : 186–91. [Google Scholar]
- May WS, Tyler PG, Ito T, Armstong DK, Qastsha A, Davidson NE. Interleukin-3 and bryostatin-1 mediate hyperphosphorylation of Bcl-2α in association with suppression of apoptosis. J Biol Chem 1994; 269 : 26865–70. [Google Scholar]
- Ito T, Deng X, Carr B, May WS. Bcl-2 phosphorylation required for anti-apoptosis function. J Biol Chem 1997; 272 : 11671–3. [Google Scholar]
- Deng X, Ito T, Carr B, Mumby M, May. Reversible phosphorylation of Bcl-2 following IL-3 or Bryostatin 1 is mediated by direct interaction with protein phosphatase 2A. J Biol Chem 1998; 273 : 34157–63. [Google Scholar]
- Dohadwala M, Cruz e Silva EF, Hall FL, et al. Phosphorylation and inactivation of protein phosphatase 1 by cyclin-dependent kinases. Proc Natl Acad Sci USA 1994; 91 : 6408–12. [Google Scholar]
© 2001 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. PP1, une nouvelle phosphatase qui contrôle la survie des cellules. Les facteurs de survie provoquent l’activation de la phosphatidylinositol-3 kinase (PI3K) et de la protéine kinase Akt. Cette dernière provoque notamment la phosphorylation de la sérine 136 de la protéine pro-apoptotique Bad. Il est bien établi que la phosphorylation des sérines 112 et 136 de Bad entraîne sa liaison avec la protéine cytosolique 14-3-3 ce qui inhibe sa fonction pro-apoptotique [2]. Dans une lignée de lymphocytes T, l’absence de cytokines provoque l’activation de la phosphatase PP1α qui provoque la déphosphorylation des deux sérines 112 et 116 de Bad, permettant son action apoptotique. Cette activité « Bad-phosphatase » est par ailleurs activée par Ras [5]. |
| Dans le texte | |
 |
Figure 2. Modèle hypothétique de contrôle de l’apoptose par PP2A. Un des substrats de la phosphatase PP2A est la protéine-kinase Akt dont elle inhibe l’activité. De même, la déphosphorylation de Bcl-2 par PP2A inhibe son activité anti-apoptotique. En revanche, la phosphatase PP1α serait activable par PP2A. Le modèle présenté ici propose un rôle clé de PP2A dans l’apoptose, d’une part en inhibant l’activité Bad kinase d’Akt, et d’autre part en activant l’activité Bad phosphatase du complexe formé par les protéines Bad-Bcl-2-PP1α. Dans ce complexe, Bcl-2 semble jouer le rôle de sous-unité régulatrice de la phosphatase PP1α, et les cibles de PP2A pourraient être soit Bcl-2, soit PP1α, soit les deux. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




