| Numéro |
Med Sci (Paris)
Volume 17, Numéro 11, Novembre 2001
|
|
|---|---|---|
| Page(s) | 1149 - 1157 | |
| Section | Articles de Synthèse | |
| DOI | https://doi.org/10.1051/medsci/200117111149 | |
| Publié en ligne | 15 novembre 2001 | |
Maladies par expansion de polyglutamine : données moléculaires et physiopathologiques
Polyglutamine expansion diseases: molecular and pathophysiological datas
1
Inserm U. 289 et Institut fédératif de recherche des neurosciences
2
Inserm U. 289, Institut fédératif de recherche des neurosciences, département de génétique, cytogénétique et embryologie, Fédération de neurologie, Groupe hospitalier Pitié-Salpêtrière, 47, boulevard de l’Hôpital, 75651 Paris Cedex 13, France
Dix ans se sont écoulés depuis l’identification d’une nouvelle classe de mutations responsables de maladies neurologiques héréditaires dues à la répétition d’un trinucléotide CAG dont la conséquence est une expansion de polyglutamine dans la protéine correspondante. Ce type de mutation, dite instable, est aujourd’hui impliqué dans neuf maladies neurodégénératives. Il a été proposé que l’expansion de polyglutamine pourrait conférer un gain de fonction à la protéine mutée et serait impliquée dans la mort neuronale par un mécanisme physiopathologique probablement com-mun à toutes les maladies par expansion de polyglutamine. La connaissance de certains des évènements impliqués dans le déclenchement du processus pathologique permet aujourd’hui d’envisager des cibles thérapeutiques, certaines d’entre elles sont d’ailleurs actuellement testées sur des modèles animaux et chez l’homme.
Abstract
Over the past ten years, a growing number of hereditary neurodegenerative diseases have been associated with the expansion of an unstable trinucleotide CAG repeat coding for a polyglutamine tract in the respective protein. To date, this type of mutation have been found to cause nine neurodegenerative diseases : Huntington disease (HD), spinobulbar muscular atrophy (SBMA), dentatorubropallidoluysian atrophy (DRPLA) and six types of spinocerebellar ataxias (SCA). Several common features characterize this group of diseases, especially dominant inheritance (except SBMA) and anticipation (earlier age atonset and more rapid disease progression in successive generations). Expanded polyglutamine tract renders the protein toxic and leads to aggregation in cells. These aggregates stain positively for ubiquitin, chaperons and proteasome, providing evidence that there are features common to the pathogenesis of these disorders. In this review, we summarize the model systems that have given insights into pathogenesis. Progress in the development of cellular and animal models provide resources for studying the disease mechanism and will be useful for screening and evaluating possible therapeutic strategies.
© 2001 médecine/sciences - Inserm / SRMS
Les progrès réalisés dans les domaines de la génétique et de la biologie moléculaire ont profondément modifié la connaissance des maladies neurologiques héréditaires. Une nouvelle classe de mutation a ainsi été impliquée dans une dizaine d’affections : il s’agit de mutations dynamiques ou instables dues à l’expansion de trinucléotides CAG dont la conséquence est une expansion de polyglutamine dans la protéine correspondante [1]. Ces trinucléotides CAG répétés sont polymorphes dans la population générale et il existe un seuil de répétitions, variable en fonction du locus considéré, au-delà duquel le phénotype se manifeste.
Ce groupe d’affections comporte la maladie de Huntington (MH), six formes d’ataxies cérébelleuses autosomiques dominantes (ADCA), l’atrophie dentato-rubro-pallido-luysienne (DRPLA) et la maladie de Kennedy ou amyotrophie spino-bulbaire (SBMA). La MH a une prévalence d’environ 5 à 10/100 000 en Europe de l’Ouest et se caractérise par la présence de mouvements anormaux involontaires (syndrome choréique), de troubles cognitifs et psychiatriques. L’évolution de la maladie conduit progressivement à une perte d’autonomie et à un tableau clinique très sévère. Les ADCA (autosomal dominant cerebellar ataxia) ont une prévalence de moins de 5/100 000 et se caractérisent par un trouble de la coordination des mouvements dû à l’atteinte du cervelet et/ou de ses afférences et efférences. Le tableau clinique peut aller de l’ataxie cérébelleuse pure à des profils cliniques beaucoup plus complexes. La DRPLA (dentato-rubral-pallido-luysian atrophy) a une prévalence d’environ 0,2 à 0,7/100 000 au Japon, mais est extrêmement rare en Amérique du Nord et en Europe. Elle a été rapprochée des ADCA du fait de l’existence d’une ataxie cérébelleuse quasi constante, d’une atteinte sévère du noyau dentelé et, à un moindre degré, d’une atteinte du cortex cérébral. Enfin, la maladie de Kennedy ou SBMA (spinal and bulbar muscular atrophy) est une maladie rare, caractérisée par une perte des neurones moteurs des nerfs crâniens et de la moelle. Dans l’ensemble de ces affections dont le début est souvent tardif, il y a probablement deux à trois fois plus de porteurs encore asymptomatiques que d’individus atteints.
Ces maladies ont une transmission autosomique dominante (sauf la SBMA dont la transmission est récessive liée à l’X) et partagent des caractéristiques cliniques communes parmi lesquelles le phénomène d’anticipation, c’est-à-dire un âge de début plus précoce et/ou une sévérité accrue de la maladie au cours des générations successives.
Données génétiques et moléculaires sur les maladies par expansion de polyglutamine
Identification des gènes impliqués
La première mutation par expansion de trinucléotides CAG fut identifiée en 1991 dans la SBMA, dans le premier exon du gène du récepteur des androgènes (AR) [2]. Le gène IT15 (important transcript 15) impliqué dans la MH, ainsi que les gènes impliqués dans deux formes d’ADCA (SCA1 pour spinocerebellar ataxia 1 et SCA3/MJD pour Machado Joseph Disease) et dans la DRPLA ont ensuite été identifiés par clonage positionnel [2]. Une expansion instable de trinucléotides CAG a été mise en évidence dans la région codante de chacun de ces gènes. De nouvelles stratégies d’identification de gènes contenant des expansions de CAG ont alors été développées et ont assuré le succès du clonage et/ou de la caractérisation des mutations dans les gènes SCA2, SCA6, SCA7 et TBP (TATA binding protein) (Tableau I) [1]. De façon surprenante, ce type de mutation n’a été identifié que dans des affections neurodégénératives.
Caractéristiques des gènes impliqués dans les maladies par expansion de polyglutamine.
Caractéristiques clinico-génétiques
La plupart de ces affections partagent des caractéristiques cliniques communes : elles débutent le plus souvent à l’âge adulte et le phénotype s’aggrave au cours des générations successives, conduisant parfois à l’apparition de cas juvéniles. L’étiologie de la maladie est inconnue, ainsi que la cause de la mort sélective de certaines populations neuronales, populations variant d’une maladie à l’autre. Aucun traitement autre que symptomatique n’est disponible pour ces affections et leur évolution est, pour la plupart, souvent grave, lentement progressive, irréversible et fatale en 10 à 20 ans.
Les mutations causales partagent des propriétés permettant de suspecter un mécanisme physiopathologique commun : l’apparition des troubles au-delà d’un seuil (en règle générale 30-40 CAG, voir Tableau I), l’existence d’une corrélation inverse entre le nombre de répétitions CAG sur l’allèle muté et l’âge de début de la maladie, l’instabilité de la répétition CAG lors des transmissions (à l’exception de SCA6). Ainsi, alors que les allèles normaux sont transmis sans modification à la descendance, les allèles avec expansion sont instables et sont transmis avec une tendance à l’augmentation du nombre de répétitions au cours des générations. Cette instabilité rend compte du phénomène d’anticipation observé dans les familles (à l’exception de la SBMA et SCA6).
Fonction des protéines impliquées
Parmi les neuf gènes impliqués à ce jour dans des maladies par expansion de polyglutamine, trois codent pour des protéines de fonctions connues : le récepteur des androgènes dans la SBMA, le gène CACNA1A codant pour la sous-unité α d’un canal calcique voltage dépendant dans SCA6, la TATA binding protein dans une ADCA.
Les séquences protéiques des neuf protéines présentent peu d’homologies entre elles et avec des protéines connues. Un homopolymère de glutamine est présent dans certains facteurs de transcription (dans la TATA binding protein ou TBP, la CREB binding protein ou CBP…) et peut suffire pour activer la transcription d’un gène rapporteur quand il est fusionné au domaine de liaison à l’ADN du facteur de transcription GAL4 [3]. Certaines de ces protéines avec polyglutamine contiennent des séquences riches en proline qui sont parfois des domaines consensus de liaison aux domaines SH3 (pour Src homology 3) ou WW (m/s 2000, n°5, p. 611). La huntingtine semble être impliquée dans le trafic vésiculaire [2], les protéines ataxine-1 et ataxine-7 sont probablement associées à la matrice intranucléaire, et des motifs habituellement présents dans les protéines impliquées dans l’épissage des ARN messagers ont été identifiés dans l’ataxine-2 et l’atrophine-1 [2]. L’identification de partenaires protéiques connus des protéines avec polyglutamine peut apporter des informations sur leur fonction normale [4] (Tableau II). Par exemple, la huntingtine interagit avec des protéines du cytosquelette (HIP1), impliquées dans le trafic vésiculaire (SH3GL3) ou dans l’initiation de la transcription (CBP, N-CoR, mSin3A, p53, hTAFII130).
Protéines identifiées comme partenaires des protéines impliquées dans les maladies par expansion de polyglutamine [4, 40].
Hypothèses physiopathologiques
Hypothèse d’un gain de fonction toxique
Les neuf affections dues à une mutation par expansion de polyglutamine sont caractérisées par l’existence d’une mort neuronale sélective. Le mécanisme physiopathologique en cause reste mal connu. Il semble toutefois qu’il s’agisse d’un gain de fonction, c’est-à-dire de l’acquisition par la protéine mutée d’une fonction nouvelle. Plusieurs arguments sont compatibles avec cette hypothèse et vont à l’encontre d’une perte de fonction.
-
Les patients qui présentent une diminution de 50 % de l’expression de la huntingtine par délétion d’un des allèles du gène IT15 ne présentent pas le phénotype MH [5].
-
Les patients homozygotes pour une mutation dans le gène IT15 (MH) ont le même âge de début que les patients hétérozygotes avec des nombres de répétitions CAG comparables [6, 7]. Cependant, cette notion doit être considérée avec prudence car très discutée, notamment dans les cas de patients homozygotes pour une mutation dans le gène de la DRPLA [8].
-
Les patients atteints d’un syndrome du testicule féminisant présentent une perte totale de la fonction du récepteur aux androgènes (AR) mais pas de phénotype neurologique [9]. Chez les patients SBMA, une perte partielle de la fonction du gène AR explique la résistance modérée aux androgènes, mais ne rend pas compte de la perte neuronale sélective des motoneurones observée dans cette affection [10].
-
Les souris homozygotes pour l’inactivation (souris knock out ou KO) de l’homologue murin du gène IT15 (MH) présentent une mort embryonnaire précoce, phénotype radicalement différent de la MH. Ce phénotype létal disparaît lors du croisement de souris hétérozygotes pour le KO et de souris transgéniques porteuses d’un YAC (chromosome artificiel de levure) contenant le gène IT15 humain, même porteur d’une expansion de (CAG)n : une seule copie du gène IT15 (gène humain apporté par le YAC, mais pas de gène souris) restaure la viabilité des souris KO [11]. Ce gain de fonction pourrait intervenir au niveau protéique, la toxicité de la protéine mutée augmentant avec la longueur de la polyglutamine. Cattaneo et al. évoquent toutefois une autre hypothèse selon laquelle il existerait un effet délétère lié à la baisse d’expression de l’allèle sain, mais cette hypothèse reste encore à confirmer [12].
Inclusions neuronales intranucléaires
-
Mise en évidence des inclusions
L’hypothèse d’un changement de conformation de la protéine à partir d’un nombre seuil de répétitions de glutamine a été suggérée. Ainsi, la conformation des protéines avec expansion de polyglutamine est altérée et celles-ci s’agrégent sous forme d’inclusions neuronales intranucléaires (NII pour neuronal intranuclear inclusions). Ces NIIs ont d’abord été mises en évidence dans un modèle murin de MH [13] puis dans des cerveaux de patients au cours de la plupart de ces maladies, SCA6 faisant exception car la protéine mutée est détectée dans des inclusions périnucléaires (pour revue, voir [14]). Les NII se présentent sous la forme de structures arrondies d’environ 1 à 2 µm de diamètre et sont fréquemment détectées par l’anticorps 1C2 qui reconnaît spécifiquement les expansions de polyglutamine et par des anticorps dirigés contre l’ubiquitine (m/s 1998, n°6-7, p. 758). DiFiglia et al. ont également rapporté la présence de granules, de filaments parallèles et de fibrilles orientées au hasard dans des NII observées chez des patients avec MH [14]. De plus, il existe chez ces patients des dépôts protéiques dans les neurites dystrophiques et dans le neuropile [14].
De façon complémentaire, Scherzinger et al. ont étudié le comportement de fragments de huntingtine recombinante [15]. In vitro et dans les cellules Cos-1, la formation des agrégats débute à une taille similaire au seuil minimum observé chez les patients avec MH (37-38 glutamines) [15]. Ce processus nécessite une étape initiale de nucléation qui est dépendante de la longueur de l’expansion, de la concentration et du temps. Ce processus très progressif d’agrégation pourrait expliquer l’âge de début tardif d’apparition des premiers symptômes chez les patients porteurs de petites expansions.
Rôle des inclusions dans la pathogénie
Des modèles cellulaires de ces maladies reproduisent les processus d’agrégation et de dysfonctionnement cellulaire, des modèles murins miment la pathologie humaine avec un phénotype neurologique progressif et la formation de NII [2]. Soulignons ici l’intérêt d’un modèle SCA7 avec dégénérescence rétinienne [16] et d’un modèle MH avec expression inductible du transgène [17]. Ce modèle inductible est particulièrement intéressant car lorsque l’on stoppe l’induction de l’expression de la protéine mutée chez la souris déjà malade, il existe une diminution des symptômes et de la formation des NII, ce qui permet d’envisager l’hypothèse d’une réversibilité des symptômes dans la MH [17].
Il existe cependant une dissociation entre la présence de NII et la mort neuronale. Ainsi, Klement et al. ont produit un modèle murin SCA1 surexprimant l’ataxine-1 délétée de son domaine d’autoassemblage : la souris développe une ataxie proche du phénotype SCA1 sans formation de NII, ce qui indiquerait que les NII ne sont pas nécessaires à la pathogénie [18]. De plus, dans des cerveaux de patients MH en post-mortem, certains neurones du striatum normalement très atteints dans la maladie présentent une faible densité de NII [19]. Enfin, l’observation d’agrégats dans des tissus non neuronaux de patients SBMA [20] et d’un modèle murin MH [21] indique que l’agrégation peut survenir en l’absence de facteurs spécifiques des neurones et que les inclusions ne sont pas suffisantes pour induire la mort cellulaire. Un modèle MH de neurones en culture primaire confirme cette absence de corrélation entre mort neuronale et formation des inclusions [22]. Dans le cas particulier de SCA6, la modification des propriétés électrophysiologiques du canal calcique de type P/Q due à la petite expansion de polyglutamine (20-21 à 33 CAG) suffirait à expliquer la mort neuronale [23].
Le rôle des NII dans la pathogénie n’est donc pas clair. Il est maintenant évident qu’elles séquestrent de nombreuses protéines indispensables au fonctionnement de la cellule (facteurs de transcription, co-activateurs et co-répresseurs du complexe d’initiation de la transcription, protéines chaperons, sous-unités du protéasome – voir plus loin) [1, 24] (figure 1). Cependant, le début souvent tardif et la progression lente de ces maladies suggèrent que l’atteinte neuronale se fait en plusieurs étapes, avec une période précoce et prolongée de dysfonctionnement neuronal suivie d’une mort neuronale tardive. La maladie débute en effet le plus souvent à l’âge adulte, alors que la protéine mutée s’exprime pendant toute la vie. Ce délai suggère qu’il existe une accumulation de produits toxiques ou une atteinte cumulative des processus cellulaires (fonctionnement des mitochondries, transport axonal des protéines, organisation de la matrice nucléaire…). Les NII pourraient jouer un rôle tardif dans la pathogénie et compromettre, à terme, la survie de la cellule.
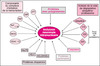 |
Figure 1. Principaux composants identifiés des inclusions neuronales intranucléaires (NII) présentes dans les maladies par expansion de polyglutamine dans les cerveaux des patients, et dans les modèles murins et cellulaires de ces maladies. CBP : CREB-binding protein ; TBP : TAT-binding protein ;HDAC:Histone déacétylase; Hsc : heat shock cognate;HDJ1/2 :protéines de la famille des HSP40. |
 |
Figure 2. Schéma récapitulatif des étapes clés ou des acteurs du mécanisme physiopathologique en jeu dans les maladies par expansion de polygluta-mine. PolyQ : polyglutamine. |
Étapes clés du mécanisme physiopathologique
Certaines des étapes clés et certains des acteurs du mécanisme physiopathologique en jeu dans les maladies par expansion de polyglutamine sont maintenant identifiés. La chronologie des événements primaires du dysfonctionnement cellulaire et des événements secondaires conduisant à la mort neuronale est cependant encore mal connue. L’expression de la protéine mutée dans le noyau a de multiples conséquences qui pourraient concourir au dysfonctionnement et à la mort neuronale.
-
Mort neuronale
Initialement, l’hypothèse d’un phénomène excitotoxique (m/s 2000, n° 1, p. 57) a été proposée pour expliquer comment un neurone peut, en l’absence d’une affection aiguë ou d’un traumatisme, être conduit à la mort cellulaire. L’excitotoxicité consiste en une activation excessive des récepteurs au glutamate de type NMDA (N-méthyl-D-aspartate), cela conduisant à l’ouverture d’un canal calcique associé, une entrée massive de calcium dans la cellule et l’activation de nombreuses voies biochimiques. L’hypothèse d’une activation de la cascade excitotoxique a trouvé sa première illustration avec les modèles animaux de MH produits par administration de 3-nitropropionate (3-NP, toxine mitochondriale) chez le primate et le rat [28] (m/s 1998, n°8-9, p. 997). Cependant, aucune augmentation anormale du glutamate extracellulaire n’a été mise en évidence chez les patients avec MH. Il s’agirait plutôt d’un phénomène d’excitotoxicité indirecte par « sensibilisation » des récepteurs NMDA, suffisante pour que des concentrations physiologiques de glutamate deviennent excitotoxiques (m/s 2000, n° 1, p. 57). L’existence d’une atteinte mitochondriale et d’un déficit énergétique chronique qui en découle déclencheraient alors la cascade excitotoxique [29].
Les données histologiques obtenues de l’observation de cerveaux de patients MH en post-mortem et de modèles murins indiquent que les neurones atteints n’ont pas toujours des critères morphologiques classiques d’apoptose [30]. Certains acteurs de la voie apoptotique sont cependant activés dans la mort induite par la polyglutamine (c-Jun amino-terminal kinase, caspases) (m/s 1998, n° 1, p. 9). Ainsi, il existe une élévation de l’interleukine-1β, marqueur d’une activation de la caspase-1, dans le cerveau de patients MH et du modèle murin MH R6/2 [31]. Ona et al. ont fait des croisements de ce modèle murin R6/2 avec une souche de souris exprimant un mutant dominant négatif de la caspase-1 sous un promoteur spécifique des neurones. L’absence de caspase-1 dans le cerveau favorise la survie des neurones, augmente le délai d’apparition des NII et des symptômes de la maladie, diminue l’altération des récepteurs de certains neurotransmetteurs [31]. De plus, l’administration intra-cérébroventriculaire d’un inhibiteur pan-spécifique de caspases ralentit aussi la progression de la maladie et allonge la durée de vie des souris R6/2 [31].
Certaines des protéines avec polyglutamine sont très probablement ellesmêmes des substrats des caspases [32] et, plutôt que la protéine entière, c’est un fragment de clivage porteur de la polyglutamine qui est transloqué dans le noyau. Des inhibiteurs spécifiques de caspases inhibent ce clivage et permettent de diminuer la mort cellulaire et la formation des agrégats dans des modèles cellulaires [32]. Le clivage protéolytique pourrait moduler la cytotoxicité, la formation des agrégats, parfois la localisation sub-cellulaire de la protéine avec polyglutamine. Le mécanisme de mort cellulaire en jeu ne serait ni de l’apoptose, ni de la nécrose mais entraînerait l’activation de plusieurs voies biochimiques également empruntées lors de l’apoptose.
Perturbation des fonctions nucléaires
La localisation nucléaire des protéines avec polyglutamine a clairement été impliquée dans la pathogenèse (sauf pour SCA6). Différentes hypothèses sont proposées pour expliquer l’effet de l’environnement nucléaire sur l’agrégation. Il pourrait exister une différence entre compartiments cellulaires dans la capacité de « métaboliser » l’expansion de polyglutamine (différence de composition en protéines chaperons, en sousunités du protéasome) : le noyau pourrait être moins efficace que le cytoplasme à dégrader, à restaurer la conformation ou à désagréger les protéines mal conformées. La compartimentation du noyau pourrait concentrer la protéine mutée dans des sous-domaines qui favorisent l’agrégation. Enfin, des protéines nucléaires pourraient favoriser l’agré-gation. Le noyau serait ainsi à la fois un site promoteur de l’agrégation – en raison de sa structure – et un compartiment cellulaire sensible à la toxicité de la polyglutamine.
Plusieurs observations soulignent l’implication du noyau dans ces pathologies. Il existe une désorganisation de l’architecture cellulaire – de la matrice nucléaire notamment dans plusieurs de ces maladies, avec une redistribution de la protéine nucléaire PML (promyelocytic leukaemia protein) [25, 26]. Il a aussi été montré que les protéines avec expansion de polyglutamine perturbent précocement la régulation transcriptionnelle de nombreux gènes conduisant à un dysfonctionnement neuronal et à une dégénérescence [4]. Il n’existe pas de diminution globale de l’expression des gènes, mais une diminution sélective et séquentielle de certains gènes (notamment des gènes impliqués dans le contrôle du calcium intracellulaire et de la recapture du glutamate, ce qui est en faveur d’une hypothèse excitotoxique) [27]. Le complexe d’initiation de la transcription (m/s 2000, n°5, p. 593) est perturbé, entraînant une modification de l’activité transcriptionnelle de nombreux facteurs nucléaires, l’altération de la localisation normale de ces protéines et leur recrutement dans les NII [1]. L’interaction de la protéine avec polyglutamine avec des facteurs de transcription et des co-activateurs du complexe d’initiation de la transcription interfère spécifiquement avec la transcription de leurs gènes cibles [4].
Certains des gènes déréglés pourraient être impliqués dans la survie cellulaire ou dans des voies de mort cellulaire par apoptose. Ce défaut de contrôle transcriptionnel peut donc être du à la déplétion cellulaire en protéines séquestrées dans les NII (TBP, CBP…), protéines parfois en quantité limitante dans la cellule, mais aussi à l’altération de l’architecture nucléaire, ce qui peut affecter les fonctions nucléaires en entraînant la redistribution de protéines comme PML et donc interférer avec leur fonction normale. Enfin, l’activité du protéasome nucléaire est perturbée et peut conduire à défaut de contrôle de certaines protéines (NF-κB, p53…) dont il assure la dégradation.
Implication de protéines chaperons
Les protéines chaperons (m/s 2000, n°5, p. 630) sont probablement impliquées dans les maladies par expansion de polyglutamine, du fait de leur co-localisation avec les NII et parfois de leur induction dans les cellules qui expriment des protéines avec expansion de polyglutamine. Ainsi, la redistribution des protéines HSP (heat shock proteins) dans les NII pourrait être une réponse cellulaire au stress due à la présence des protéines avec polyglutamine mal structurées et agrégées, d’où une diminution de la quantité de protéines chaperons fonctionnelles qui ne pourraient plus assurer leur rôle. En effet, la surexpression de certaines d’entre elles (HDJ1, HDJ2/HSDJ, HSP40, HSP70) dans des modèles cellulaires et animaux permet la diminution de l’agrégation et de la mort cellulaire [33].
Implication de la voie de dégradation ubiquitine-protéasome
L’agrégation de protéines mal conformées et ubiquitinylées est un point commun à de nombreuses maladies neurodégénératives, telles que certaines formes de la maladie de Parkinson, la maladie d’Alzheimer, la sclérose latérale amyotrophique et les maladies dues à la protéine prion [34]. Des dysfonctionnements de la voie de dégradation par le protéasome (voie UPS pour ubiquitin-proteasome system) ont été décrits dans des maladies variées, incluant certains cancers et des affections virales [35] (m/s 2000, n°5, p. 623). La voie UPS est aussi très probablement impliquée dans la pathogenèse des maladies par expansion de polyglutamine car des sous-unités du protéasome colocalisent avec les NII et certains acteurs de cette voie de dégradation interagissent avec les protéines avec polyglutamine. Enfin, des inhibiteurs spécifiques du protéasome favorisent l’agrégation de ces protéines dans des modèles cellulaires [36].
Certaines des protéines avec expansion de polyglutamine sont ubiquitinylées [36, 37] et dégradées par le protéasome in vitro [36]. Ainsi, les ataxines-1 normale et mutée sont ubiquitinylées de façon identique, mais la protéine mutée semble trois fois plus résistante à la dégradation que la protéine normale [36]. Il y aurait donc une accumulation de forme insoluble de la protéine mutée [36]. Le facteur limitant dans la clairance en protéine mutée ne semble donc pas être l’ubiquitinylation mais la reconnaissance ou l’hydrolyse par le protéasome. Bence et al. ont ainsi confirmé in vitro que l’agrégation protéique conduit à l’accumulation de protéines ubiquitinylées et à l’arrêt du cycle cellulaire : les agrégats pourraient inhiber la voie UPS par saturation de la capacité d’une ou de plusieurs protéines chaperons nécessaires au fonctionnement de la voie UPS ou par interaction directe avec le protéasome [38].
Vulnérabilité sélective
Malgré une expression souvent ubiquitaire des protéines avec expansion de polyglutamine, seules certaines populations de neurones dégénèrent. Différentes hypothèses pourraient expliquer cette vulnérabilité particulière et donc la sélectivité des lésions observées dans chacune des maladies par expansion de polyglutamine.
-
Le niveau d’expression du transcrit ou de la protéine pathologique dans les neurones varie certainement d’une structure à l’autre et pourrait contribuer à la différence de concentration cellulaire en monomères mal conformés dans les différentes structures cérébrales.
-
Les modifications post-traductionnelles pourraient varier d’une structure à l’autre, notamment le clivage de la protéine mutée par des protéases spécifiques (caspases) ou le cross-linking éventuel par des transglutaminases [1].
-
Il pourrait exister des différences quantitatives ou qualitatives en certains facteurs cellulaires tels que des protéines impliquées dans la dégradation des protéines mutées (acteurs de la voie UPS) ou d’autres protéines à domaine polyglutamine (tels que des facteurs de transcription) qui coagrègent dans des compartiments cellulaires spécifiques ou à des étapes particulières du développement.
-
L’instabilité de la répétition CAG pourrait varier d’un tissu à l’autre et l’existence d’un mosaïcisme somatique pourrait expliquer la vulnérabilité particulière de certaines structures cérébrales. Ainsi, il a été montré qu’il existait une très grande instabilité dans le striatum d’un modèle murin de MH [39].
-
Enfin, la nature des protéines partenaires spécifiques pourrait contribuer à l’atteinte sélective. En effet, un changement de conformation de la protéine mutée est compatible avec l’hypothèse d’une interaction spécifique de la protéine mutée avec des protéines dont la topographie d’expression pourrait correspondre aux structures qui dégénèrent. Des protéines partenaires qui s’accumulent dans les NII ou dont l’affinité pour la protéine avec expansion de polyglutamine varie avec la taille de la polyglutamine pourraient ainsi être impliquées dans le processus de mort neuronale et l’atteinte sélective (Tableau II).
En l’absence d’arguments expérimentaux évidents, aucune de ces hypothèses n’est actuellement favorisée. Cependant, la dernière hypothèse concernant l’existence de partenaires ou d’une combinaison de partenaires spécifiques responsables de l’atteinte sélective dans chacune des maladies nous a conduits à rechercher les partenaires de l’ataxine-7 mutée, lesquels sont en cours de caractérisation [40].
Conclusions
Aucune thérapeutique efficace n’est actuellement disponible pour traiter ou ralentir l’évolution des maladies par expansion de polyglutamine. Récemment, des expériences de greffes de neurones fœtaux de striatum ont été testées sur des modèles animaux de la MH et ont permis une amélioration des performances motrices et une restauration complète des fonctions cognitives des animaux (m/s 1998, n° 8-9, p. 997). Devant les résultats encourageants obtenus notamment chez le primate, des greffes de neurones fœtaux humains ont été pratiquées chez des patients atteints de MH [41, 42]. Les neurones fœtaux survivent pendant au moins dix huit mois après greffe, développent des caractéristiques phénotypiques de neurones striataux mûrs et permettent une amélioration clinique dans certains cas [41]. Il reste à évaluer leur capacité à restaurer des circuits fonctionnels dans les ganglions de la base et à compenser la progression de la mort neuronale à long terme.
La connaissance des étapes clés du mécanisme impliqué dans le processus pathologique est indispensable pour envisager d’autres approches thérapeutiques. Compte tenu du nombre d’hypothèses avancées, comprendre ce mécanisme paraît ardu mais il faut espérer que la construction récente de nombreux modèles cellulaires et animaux y contribuera. Les effets bénéfiques recherchés des futures thérapeutiques seront l’augmentation de la survie cellulaire et le ralentissement de la formation des agrégats mais surtout le maintien ou la restauration fonctionnelle des neurones affectés. Il est probable que la combinaison de différentes approches sera nécessaire pour obtenir des résultats en termes de protection cellulaire
Remerciements
Nos plus vifs remerciements vont au Dr Giovanni Stevanin qui a grandement contribué à la conception de cette revue. Nos travaux sont financés par l’Institut National de la Santé et de la Recherche Médicale (Inserm), la fondation VERUM, l’Association Française de lutte contre les Myopathies (AFM), le Ministère de la Recherche (Action concertée incitative « Biologie du développement et physiologie intégrative 2000 ») et l’Association pour le Développement de la Recherche sur les Maladies Génétiques Neurologiques et Psychiatriques (ADRMGNP).
Références
- Cummings CJ, Zoghbi HY. Fourteen and counting : unraveling trinucleotide repeat diseases. Hum Mol Genet 2000; 9 : 909–16. [Google Scholar]
- Zoghbi HY, Orr HT. Glutamine repeats and neurodegeneration. Annu Rev Neurosci 2000; 23 : 217–47. [Google Scholar]
- Gerber HP, Seipel K, Georgiev O, et al. Transcriptional activation modulated by homopolymeric glutamine and proline stretches. Science 1994; 263 : 808–11. [Google Scholar]
- Shimohata T, Onodera O, Tsuji S. Interaction of expanded polyglutamine stretches with nuclear transcription factors leads to aberrant transcriptional regulation in polyglutamine diseases. Neuropathology 2000; 20 : 326–33. [Google Scholar]
- Ambrose CM, Duyao MP, Barnes G, et al. Structure and expression of the Huntington’s disease gene : evidence against simple inactivation due to an expanded CAG repeat. Somat Cell Mol Genet 1994; 20 : 27–38. [Google Scholar]
- Wexler NS, Young AB, Tanzi RE, et al. Homozygotes for Huntington’s disease. Nature 1987; 326 : 194–7. [Google Scholar]
- Durr A, Hahn-Barma V, Brice A, Pecheux C, Dode C, Feingold J. Homozygosity in Huntington’s disease. J Med Genet 1999; 36 : 172–3. [Google Scholar]
- Sato K, Kashihara K, Okada S, et al. Does homozygosity advance the onset of dentatorubral-pallidoluysian atrophy ? Neurology 1995; 45 : 1934–6. [Google Scholar]
- Quigley CA, Friedman KJ, Johnson A, et al. Complete deletion of the androgen receptor gene : definition of the null phenotype of the androgen insensitivity syndrome and determination of carrier status. J Clin Endocrinol Metab 1992; 74 : 927–33. [Google Scholar]
- Robitaille Y, Lopes-Cendes I, Becher M, Rouleau G, Clark AW. The neuropathology of CAG repeat diseases : review and update of genetic and molecular features. Brain Pathol 1997; 7 : 901–26. [Google Scholar]
- Hodgson JG, Smith DJ, McCutcheon K, et al. Human huntingtin derived from YAC transgenes compensates for loss of murine huntingtin by rescue of the embryonic lethal phenotype. Hum Mol Genet 1996; 5 : 1875–85. [Google Scholar]
- Cattaneo E, Rigamonti D, Goffredo D, Zuccato C, Squitieri F, Sipione S. Loss of normal huntingtin function : new developments in Huntington’s disease research. Trends Neurosci 2001; 24 : 182–8. [Google Scholar]
- Davies SW, Turmaine M, Cozens BA, et al. Formation of neuronal intranuclear inclusions (NII) underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell 1997; 90 : 537–48. [Google Scholar]
- Paulson HL. Toward an understanding of polyglutamine neurodegeneration. Brain Pathol 2000; 10 : 293–9. [Google Scholar]
- Scherzinger E, Sittler A, Schweiger K, et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils : implications for Huntington’s disease pathology. Proc Natl Acad Sci USA 1999; 96 : 4604–9. [Google Scholar]
- Yvert G, Lindenberg KS, Picaud S, Landwehrmeyer GB, Sahel JA, Mandel JL. Expanded polyglutamines induce neurodegeneration and trans-neuronal alterations in cerebellum and retina of SCA7 transgenic mice. Hum Mol Genet 2000; 9 : 2491–506. [Google Scholar]
- Yamamoto A, Lucas JJ, Hen R. Reversal of neuropathology and motor dysfunction in a conditional model of Huntington’s disease. Cell 2000; 101 : 57–66. [Google Scholar]
- Klement IA, Skinner PJ, Kaytor MD, et al. Ataxin-1 nuclear localization and aggregation : role in polyglutamine-induced disease in SCA1 transgenic mice. Cell 1998; 95 : 41–53. [Google Scholar]
- Gutekunst CA, Li SH, Yi H, et al. Nuclear and neuropil aggregates in Huntington’s disease : relationship to neuropathology. J Neurosci 1999; 19 : 2522–34. [Google Scholar]
- Li M, Nakagomi Y, Kobayashi Y, et al. Nonneural nuclear inclusions of androgen receptor protein in spinal and bulbar muscular atrophy. Am J Pathol 1998; 153 : 695–701. [Google Scholar]
- Sathasivam K, Hobbs C, Turmaine M, et al. Formation of polyglutamine inclusions in non-CNS tissue. Hum Mol Genet 1999; 8 : 813–22. [Google Scholar]
- Saudou F, Finkbeiner S, Devys D, Greenberg ME. Huntingtin acts in the nucleus to induce apoptosis but death does not correlate with the formation of intranuclear inclusions. Cell 1998; 95 : 55–66. [Google Scholar]
- Toru S, Murakoshi T, Ishikawa K, et al. Spinocerebellar ataxia type 6 mutation alters P-type calcium channel function. J Biol Chem 2000; 275 : 10893–8. [Google Scholar]
- Shimohata T, Nakajima T, Yamada M, et al. Expanded polyglutamine stretches interact with TAFII130, interfering with CREB-dependent transcription. Nat Genet 2000; 26 : 29–36. [Google Scholar]
- Skinner PJ, Koshy BT, Cummings CJ, et al. Ataxin-1 with an expanded glutamine tract alters nuclear matrix-associated structures. Nature 1997; 389 : 971–4. [Google Scholar]
- Kaytor MD, Duvick LA, Skinner PJ, Koob MD, Ranum LP, Orr HT. Nuclear localization of the spinocerebellar ataxia type 7 protein, ataxin-7. Hum Mol Genet 1999; 8 : 1657–64. [Google Scholar]
- Lin X, Antalffy B, Kang D, Orr HT, Zoghbi HY. Polyglutamine expansion downregulates specific neuronal genes before pathologic changes in SCA1. Nat Neurosci 2000; 3 : 157–63. [Google Scholar]
- Brouillet E, Conde F, Beal MF, Hantraye P. Replicating Huntington’s disease phenotype in experimental animals. Prog Neurobiol 1999; 59 : 427–68. [Google Scholar]
- Koroshetz WJ, Jenkins BG, Rosen BR, Beal MF. Energy metabolism defects in Huntington’s disease and effects of coenzyme Q10. Ann Neurol 1997; 41 : 160–5. [Google Scholar]
- Turmaine M, Raza A, Mahal A, Mangiarini L, Bates GP, Davies SW. Nonapoptotic neurodegeneration in a transgenic mouse model of Huntington’s disease. Proc Natl Acad Sci USA 2000; 97 : 8093–7. [Google Scholar]
- Ona VO, Li M, Vonsattel JP, et al. Inhibition of caspase-1 slows disease progression in a mouse model of Huntington’s disease. Nature 1999; 399 : 263–7. [Google Scholar]
- Wellington CL, Hayden MR. Caspases and neurodegeneration : on the cutting edge of new therapeutic approaches. Clin Genet 2000; 57 : 1–10. [Google Scholar]
- Kobayashi Y, Kume A, Li M, et al. Chaperones Hsp70 and Hsp40 suppress aggregate formation and apoptosis in cultured neuronal cells expressing truncated androgen receptor protein with expanded polyglutamine tract. J Biol Chem 2000; 275 : 8772–8. [Google Scholar]
- Alves-Rodrigues A, Gregori L, Figueiredo-Pereira ME. Ubiquitin, cellular inclusions and their role in neurodegeneration. Trends Neurosci 1998; 21 : 516–20. [Google Scholar]
- Ciechanover A, Orian A, Schwartz AL. The ubiquitin-mediated proteolytic pathway : mode of action and clinical implications. J Cell Biochem 2000; 34 (suppl) : 40–51. [Google Scholar]
- Cummings CJ, Reinstein E, Sun Y, et al. Mutation of the E6-AP ubiquitin ligase reduces nuclear inclusion frequency while accelerating polyglutamine-induced pathology in SCA1 mice. Neuron 1999; 24 : 879–92. [Google Scholar]
- Kalchman MA, Graham RK, Xia G, et al. Huntingtin is ubiquitinated and interacts with a specific ubiquitin- conjugating enzyme. J Biol Chem 1996; 271 : 19385–94. [Google Scholar]
- Bence NF, Sampat RM, Kopito RR. Impairment of the ubiquitin-proteasome system by protein aggregation. Science 2001; 292 : 1552–5. [Google Scholar]
- Kennedy L, Shelbourne PF. Dramatic mutation instability in HD mouse striatum : does polyglutamine load contribute to cellspecific vulnerability in Huntington’s disease ? Hum Mol Genet 2000; 9 : 2539–44. [Google Scholar]
- Lebre AS, Jamot L, Takahashi J, et al. Ataxin-7 interacts with a Cbl-associated protein that it recruits into neuronal intranuclear inclusions. Hum Mol Genet 2001; 10 : 1201–13. [Google Scholar]
- Freeman TB, Cicchetti F, Hauser RA, et al. Transplanted fetal striatum in Huntington’s disease : phenotypic development and lack of pathology. Proc Natl Acad Sci USA 2000; 97 : 13877–82. [Google Scholar]
- Bachoud-Levi AC, Remy P, Nguyen JP, et al. Motor and cognitive improvements in patients with Huntington’s disease after neural transplantation. Lancet 2000; 356 : 1975–9. [Google Scholar]
Liste des tableaux
Caractéristiques des gènes impliqués dans les maladies par expansion de polyglutamine.
Protéines identifiées comme partenaires des protéines impliquées dans les maladies par expansion de polyglutamine [4, 40].
Liste des figures
 |
Figure 1. Principaux composants identifiés des inclusions neuronales intranucléaires (NII) présentes dans les maladies par expansion de polyglutamine dans les cerveaux des patients, et dans les modèles murins et cellulaires de ces maladies. CBP : CREB-binding protein ; TBP : TAT-binding protein ;HDAC:Histone déacétylase; Hsc : heat shock cognate;HDJ1/2 :protéines de la famille des HSP40. |
| Dans le texte | |
 |
Figure 2. Schéma récapitulatif des étapes clés ou des acteurs du mécanisme physiopathologique en jeu dans les maladies par expansion de polygluta-mine. PolyQ : polyglutamine. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




