| Numéro |
Med Sci (Paris)
Volume 37, Novembre 2021
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 11 - 14 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2021183 | |
| Publié en ligne | 8 décembre 2021 | |
Le rôle de la matrice extracellulaire dans la régénération des nerfs moteurs
The role of extracellular matrix in the regeneration of motor nerves
Institut de Génomique Fonctionnelle de Lyon, Université de Lyon, ENS de Lyon, CNRS UMR 5242, 46 allée d’Italie, Lyon F-69364, France
* laurie.nemoz-billet@ens-lyon.fr
Abstract
The motor neurons (MN) form the ultimate route to convey the commands from the central nervous system to muscles. During development, MN extend axons that follow stereotyped trajectories to their muscle targets, guided by various attractive and repulsive molecular cues. Extracellular matrix (ECM) is a major source of guidance cues, but its role in axonal development and regeneration remains poorly documented. Regenerating axons are able to return to their synaptic target following their original trajectory. The same guidance cues could be thus involved in motor nerve regeneration. Zebrafish has become a popular model system in understanding the development of the peripheral nervous system. Thanks to the generation of fluorescent transgenic lines and the optical transparency of embryos and larvae, it allows direct visualization of axonogenesis. Additionally, and contrary to humans, its remarkable capacity to regenerate makes it well suited for the study of nerve regeneration. A laser method to ablate nerves in living zebrafish larvae has been developed in our laboratory that, combined with the use of the fluorescent mnx1:gfp zebrafish transgenic line, allows the follow up of the dynamics of the nerve regeneration process. To study the role of ECM proteins present in the axonal path, mutant lines for different ECM proteins (already available in our laboratory or generated in mnx1:gfp fish using CRISPR-Cas9 method) will be used to analyze their role during the regeneration process. These mutant lines for ECM will be crossed with existing fluorescent transgenic lines to visualize different cell types involved in the nerve regeneration, such as macrophages (mfap4:mcherry), neutrophils (mpx:gfp) or even Schwann cells (sox10:mrfp). Overall, this study will depict the role of ECM in nerve regeneration and will provide essential knowledge for the development of new biomaterials to promote the regeneration of injured motor nerves.
© 2021 médecine/sciences – Inserm
© Enzo Cohen
Contexte scientifique
Les motoneurones (MN), qui forment les nerfs, constituent le dernier relais du circuit que suivent les informations envoyées par le système nerveux central jusqu’aux muscles effecteurs pour provoquer leur contraction. Alors que le corps cellulaire des MN réside dans la moelle épinière, l’axone qu’il projette va naviguer selon un chemin stéréotypé jusqu’à sa cible musculaire avec laquelle il formera une synapse. Tout au long de sa trajectoire, il demeure étroitement associé aux cellules de Schwann qui assurent sa myélinisation et donc la bonne conduction de l’influx nerveux. Pour atteindre leur cible, les axones moteurs sont guidés par de multiples signaux attractifs ou répulsifs qui constituent le microenvironnement de l’axone en croissance [1]. Ces signaux peuvent être diffusibles ou de « contact ». Les composants de la matrice extracellulaire (MEC) constituent la source principale de ces derniers. L’absence d’un de ces signaux se traduit généralement par le déroutage plus ou moins important des axones moteurs.
Chez le poisson zèbre, le développement du système nerveux périphérique est relativement simple. Le tronc de l’embryon s’allonge par ajout régulier de somites (qui formeront les myotomes), au sein desquels s’effectue l’axonogenèse. Cette dernière s’accomplit en deux vagues donnant naissance successivement aux motoneurones primaires (pMN) puis secondaires (sMN) [2]. Les axones des pMN empruntent à la sortie de la moelle épinière une même trajectoire appelée « chemin commun » puis effectuent une pause au point de choix, qui correspond au myosepte horizontal, pour ensuite emprunter des chemins différents pour innerver un territoire musculaire spécifique (Figure 1A). Les axones des sMN suivront quelques heures plus tard le même chemin [3]. Chez la larve et chez l’adulte, les pMN et les sMN forment ensemble deux nerfs périphériques projetant ventralement et dorsalement, chacun étant constitué d’environ soixante-dix axones [4].
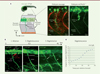 |
Figure 1. Régénération des nerfs périphériques chez le poisson zèbre. A. Trajectoire des axones au sein du myotome et influence de la matrice extracellulaire sur l’axonogenèse. A. Image en fluorescence d’un embryon de poisson zèbre transgénique mnx1:gfp à 27 hpf. La moelle épinière est visible grâce à la fluorescence des motoneurones (en vert). À ce stade, le tronc est constitué d’une succession de myotomes dont le schéma en dessous détaille l’organisation (un seul côté du myotome est représenté). Les corps cellulaires des motoneurones primaires (pMN) sont logés dans la moelle épinière et projettent chacun un axone qui suit une trajectoire stéréotypée jusqu’à sa cible musculaire pour former une synapse. Ils suivent un chemin commun et divergent dans différentes directions au point de choix pour innerver tout le myotome (une seule fibre musculaire est représentée). À droite : marquage immunofluorescent du collagène XV-B (ColXV-B) chez un embryon sauvage mnx1:gfp à 27 hpf. Le dépôt de ColXV (en rouge) au centre du somite cible très précisément la trajectoire de l’axone (en vert) selon un motif en barreau d’échelle. Le ColXV-B est aussi présent dans les myoseptes verticaux. En l’absence de ColXV-B (embryon mutant col15a1b-/-), l’axonogenèse est perturbée : ici, l’axone arrête sa croissance au niveau du point de choix (astérisque). Les lignes en pointillés indiquent la position des myoseptes. B. Régénération des nerfs chez le poisson zèbre après ablation laser. De gauche à droite : (1) ablation du nerf ventral chez la larve mnx1:gfp de 4 jpf, (2) début de la dégénérescence du nerf à 0,5 heure post-ablation et (3) régénération complète du nerf lésé 48 heures post-ablation. En (2) le trait en blanc indique la distance entre les extrémités distale et proximale du nerf lésé visualisée par l’absence de fluorescence dans ce segment du nerf, en (3) la flèche indique le nerf régénéré, l’astérisque montre un nerf non lésé. C. Dynamique de dégénérescence du nerf lésé chez les larves mnx1:gfp (n = 9). Les barres d’erreurs représentent ± SEM. pMN, motoneurone primaire ; ME, moelle épinière ; hpf, heure post-fécondation ; hpa, heure post-ablation. |
Lorsqu’un nerf périphérique est endommagé ou sectionné, les MN lésés mettent en place un programme d’expression génique qui, couplé à la présence de signaux de survie locaux, leur permet de survivre et de projeter à nouveau un axone. De façon remarquable, ceux-ci repoussent en suivant précisément la même trajectoire qu’auparavant [5]. Dans les heures qui suivent la lésion, se met en place un processus de dégénérescence dite wallérienne, un prérequis indispensable à la repousse des nerfs. Ce processus inclut la rétraction de l’extrémité proximale du nerf lésé et la dégénérescence de son extrémité distale, grâce notamment à l’action conjointe des cellules de Schwann et des macrophages recrutés sur le site de la lésion. Les cellules de Schwann qui se trouvent au niveau du nerf lésé vont rapidement se dédifférencier et sécréter des cytokines qui, en diffusant, vont attirer les macrophages. Ces deux acteurs cellulaires unissent alors leurs efforts pour éliminer les débris environnants dont notamment certains constituants de la myéline qui pourraient inhiber la régénération [6]. Chez le poisson zèbre, la régénération d’un nerf moteur périphérique qui est extrêmement rapide (et complète en 48 heures) suit pourtant le même processus [7].
Notre laboratoire a récemment montré qu’à l’instar de modèles invertébrés, comme la drosophile [8] et le nématode [9], le collagène XV joue un rôle majeur dans le guidage des axones moteurs dans l’embryon de poisson zèbre [10]. L’orthologue col15a1b du gène humain COL15A1 est exprimé par les progéniteurs musculaires lents au moment de leur spécification. Ces cellules déposent le collagène XV-B (ColXV-B) très précisément au niveau du chemin commun quelques heures seulement avant le début de l’axonogenèse (Figure 1A). Des expériences de perte et de gain de fonction réalisées au laboratoire ont montré que ColXV-B est un constituant essentiel du chemin commun requis pour la croissance et le guidage des axones moteurs chez l’embryon [10]. Son absence se caractérise en effet par la présence d’axones tronqués s’arrêtant au niveau du point de choix (Figure 1A). D’autres composants matriciels comme la ténascine C et le ColXIX sont également impliqués dans le développement des axones moteurs [11, 12] ; cependant, le rôle de la MEC dans ce processus reste peu documenté et est donc étudié dans notre laboratoire.
L’hypothèse de travail de notre projet de thèse est que la MEC pourrait également jouer un rôle clé dans la régénération des nerfs périphériques. Le projet vise ainsi à caractériser d’une part le possible remodelage de la MEC du chemin axonal après lésion du nerf et identifier la ou les sources cellulaires qui la synthétisent et d’autre part, à étudier son implication dans la régénération des nerfs moteurs après transsection du nerf par ablation laser, méthode mise au point au laboratoire dans le cadre d’un stage de Master 2.
Le poisson zèbre comme modèle
Le poisson zèbre est un petit vertébré originaire d’Asie qui possède un génome assez proche de l’Homme puisque 71 % des gènes humains ont un orthologue chez cet organisme modèle [13]. Ce petit vertébré séduit par les nombreux avantages qu’il présente et qui en font un excellent modèle de développement mais aussi pour l’étude de pathologies humaines. Parmi ceux-ci, on notera la rapidité et l’externalité de son développement embryonnaire mais aussi la transparence et la petite taille des embryons et larves qui facilitent la visualisation de multiples processus biologiques par imagerie in vivo. Par ailleurs, de multiples outils de manipulation génétique ont été adaptés à ce modèle et ont permis la création de lignées fluorescentes par transgenèse et de lignées mutantes par la technique d’édition du génome CRISPR-Cas9. Enfin, le poisson zèbre fait partie des quelques vertébrés qui possèdent une forte capacité de régénération et constitue ainsi un modèle idéal pour l’étude de la régénération de nombreux organes dont la moelle épinière, la rétine, le cœur, le foie, le rein, le pancréas mais aussi les nerfs périphériques [14].
Méthodologie
La technique d’ablation laser est réalisée sur des nerfs de larves de poisson zèbre quatre jours après fécondation des œufs (noté jpf pour jour post-fécondation). La lignée transgénique mnx1:gfp est utilisée car elle permet de visualiser directement les axones moteurs par fluorescence de la protéine GFP (green fluorescent protein). Les larves transgéniques sont anesthésiées puis placées en position latérale dans des puits (Ibidi, chambre quatre puits) et maintenues dans cette position en les enrobant d’agarose. À quatre jpf, deux nerfs moteurs sont visibles dans les larves transgéniques : un nerf ventral et un nerf dorsal ; cependant, seul le nerf ventral, plus accessible en imagerie, est analysé (Figure 1B). Afin de repérer aisément le nerf lésé ou en régénération à observer, le même nerf le long du tronc de l’animal est ciblé en prenant comme point de repère l’anus de l’animal. L’ablation est réalisée au plus près de la moelle épinière, sans l’endommager, à l’aide d’un laser UV 355 monté sur un microscope confocal inversé de type « spinning disk » possédant une enceinte thermo-régulée qui permet de garder les larves à une température de 28 °C qui est leur température d’élevage. Le laser illumine la région sélectionnée 150 fois pendant 11 ms, à une puissance de 50 %. L’ablation aboutit à un segment non fluorescent (GFP négatif) de 10 µm sur le nerf lésé, faisant apparaitre une extrémité proximale en amont du site de lésion et une extrémité distale en aval (Figure 1B). La longueur du segment s’agrandit par la suite lors de la rétractation de la partie proximale et la fragmentation de l’extrémité distale, selon le processus de dégénérescence wallérienne. Ce processus a été suivi par vidéo-microscopie, en prenant une image toutes les 30 minutes pendant 6 heures après lésion du nerf. En mesurant pour chaque nerf lésé la distance entre les extrémités proximale et distale sur les images obtenues, il a été possible de reconstruire la dynamique du processus et montrer ainsi que la dégénérescence complète du nerf lésé est atteinte entre 5 et 6 hpa (heure post-ablation) (Figure 1C). Afin d’étudier la régénération du nerf, les larves, après ablation du nerf, sont replacées en milieu d’élevage, libres de nager, puis remontées de la même façon à 48 hpa afin d’être analysées au microscope confocal. La régénération du nerf s’est avérée complète au moment de l’observation, ce qui est en accord avec les données de la littérature (Figure 1B) [7].
Cette technique permettra d’étudier l’implication de ColXV-B dans la régénération des nerfs moteurs dont le rôle dans l’axonogenèse a été démontré dans notre laboratoire [10], en utilisant des larves d’une lignée mutante col15a1b–/– croisées avec la lignée mnx1:gfp pour visualiser la repousse des axones moteurs. Des lignées mutantes pour d’autres protéines de la MEC, décrites comme étant déposées sur le chemin axonal ou dont le rôle dans l’axonogenèse a été montré, seront générées en utilisant la méthode CRISPR-Cas9 afin d’étudier leur implication, de façon individuelle ou combinée, dans la régénération des nerfs périphériques. Ces lignées mutantes pour des protéines de la MEC seront croisées avec des lignées transgéniques fluorescentes existantes qui permettent de visualiser différents types cellulaires impliqués dans la régénération des nerfs périphériques, comme les macrophages (mfap4:mCherry), les neutrophiles (mpx:gfp) ou encore les cellules de Schwann (sox10:mrfp), et étudier l’impact de l’absence de ces protéines sur la dégénérescence wallérienne en vidéomicroscopie de fluorescence.
Conclusion
Ce projet permettra d’identifier les protéines de la matrice extracellulaire qui jouent un rôle clé dans la régénération des nerfs périphériques, et de connaître précisément leur rôle dans la dynamique de ce processus. Ces connaissances seront précieuses pour élaborer dans le futur de nouveaux biomatériaux conçus pour favoriser la régénération des nerfs périphériques sur de grandes longueurs chez les personnes dont les nerfs ont été endommagés.
NDLR
Laurie Nemoz-Billet a reçu le prix spécial du jury 2020 de la SFM pour son travail de Master.
Liens d’intérêt
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Tessier-Lavigne M, Goodman CS. The molecular biology of axon guidance. Science 1996 ; 274 : 1123–1133. [CrossRef] [PubMed] [Google Scholar]
- Myers PZ. Spinal motoneurons of the larval zebrafish. J Comp Neurol 1985 ; 236 : 555–561. [CrossRef] [PubMed] [Google Scholar]
- Beattie CE. Control of motor axon guidance in the zebrafish embryo. Brain Res Bull 2000 ; 53 : 489–500. [CrossRef] [PubMed] [Google Scholar]
- Westerfield M, McMurray JV, Eisen JS. Identified motoneurons and their innervation of axial muscles in the zebrafish. J Neurosci 1986 ; 6 : 2267–2277. [CrossRef] [PubMed] [Google Scholar]
- Allodi I, Udina E, Navarro X. Specificity of peripheral nerve regeneration: interactions at the axon level. Prog Neurobiol 2012 ; 98 : 16–37. [CrossRef] [PubMed] [Google Scholar]
- Villegas R, Martin SM, O’Donnell KC, et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev 2012; 7–19. [PubMed] [Google Scholar]
- Rosenberg AF, Wolman MA, Franzini-Armstrong C, et al. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci 2012 ; 32 : 3898–3909. [CrossRef] [PubMed] [Google Scholar]
- Meyer F, Moussian B. Drosophila multiplexin (Dmp) modulates motor axon pathfinding accuracy. Dev Growth Differ 2009 ; 51 : 483–498. [CrossRef] [PubMed] [Google Scholar]
- Ackley BD, Crew JR, Elamaa H, et al. The NC1/endostatin domain of Caenorhabditis elegans type XVIII collagen affects cell migration and axon guidance. J Cell Biol 2001 ; 152 : 1219–1232. [CrossRef] [PubMed] [Google Scholar]
- Guillon E, Bretaud S, Ruggiero F. Slow muscle precursors lay down a collagen XV matrix fingerprint to guide motor axon navigation. J Neurosci 2016 ; 36 : 2663–2676. [CrossRef] [PubMed] [Google Scholar]
- Schweitzer J, Becker T, Lefebvre J, et al. Tenascin-C is involved in motor axon outgrowth in the trunk of developing zebrafish. Dev Dyn 2005 ; 234 : 550–566. [CrossRef] [PubMed] [Google Scholar]
- Hilario JD, Wang C, Beattie CE. Collagen XIXa1 is crucial for motor axon navigation at intermediate targets. Development 2010 ; 137 : 4261–4269. [CrossRef] [PubMed] [Google Scholar]
- Howe K, Clark MD, Torroja CF, et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature 2013 ; 496 : 498–503. [CrossRef] [PubMed] [Google Scholar]
- Gemberling M, Bailey TJ, Hyde DR, et al. The zebrafish as a model for complex tissue regeneration. Trends Genet 2013 ; 29 : 357–370. [Google Scholar]
Liste des figures
 |
Figure 1. Régénération des nerfs périphériques chez le poisson zèbre. A. Trajectoire des axones au sein du myotome et influence de la matrice extracellulaire sur l’axonogenèse. A. Image en fluorescence d’un embryon de poisson zèbre transgénique mnx1:gfp à 27 hpf. La moelle épinière est visible grâce à la fluorescence des motoneurones (en vert). À ce stade, le tronc est constitué d’une succession de myotomes dont le schéma en dessous détaille l’organisation (un seul côté du myotome est représenté). Les corps cellulaires des motoneurones primaires (pMN) sont logés dans la moelle épinière et projettent chacun un axone qui suit une trajectoire stéréotypée jusqu’à sa cible musculaire pour former une synapse. Ils suivent un chemin commun et divergent dans différentes directions au point de choix pour innerver tout le myotome (une seule fibre musculaire est représentée). À droite : marquage immunofluorescent du collagène XV-B (ColXV-B) chez un embryon sauvage mnx1:gfp à 27 hpf. Le dépôt de ColXV (en rouge) au centre du somite cible très précisément la trajectoire de l’axone (en vert) selon un motif en barreau d’échelle. Le ColXV-B est aussi présent dans les myoseptes verticaux. En l’absence de ColXV-B (embryon mutant col15a1b-/-), l’axonogenèse est perturbée : ici, l’axone arrête sa croissance au niveau du point de choix (astérisque). Les lignes en pointillés indiquent la position des myoseptes. B. Régénération des nerfs chez le poisson zèbre après ablation laser. De gauche à droite : (1) ablation du nerf ventral chez la larve mnx1:gfp de 4 jpf, (2) début de la dégénérescence du nerf à 0,5 heure post-ablation et (3) régénération complète du nerf lésé 48 heures post-ablation. En (2) le trait en blanc indique la distance entre les extrémités distale et proximale du nerf lésé visualisée par l’absence de fluorescence dans ce segment du nerf, en (3) la flèche indique le nerf régénéré, l’astérisque montre un nerf non lésé. C. Dynamique de dégénérescence du nerf lésé chez les larves mnx1:gfp (n = 9). Les barres d’erreurs représentent ± SEM. pMN, motoneurone primaire ; ME, moelle épinière ; hpf, heure post-fécondation ; hpa, heure post-ablation. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




