| Numéro |
Med Sci (Paris)
Volume 32, Novembre 2016
Les cahiers de myologie
|
|
|---|---|---|
| Page(s) | 30 - 39 | |
| Section | Dossier | |
| DOI | https://doi.org/10.1051/medsci/201632s209 | |
| Publié en ligne | 21 novembre 2016 | |
Thérapies cellulaires des cardiopathies
Évolution du paradigme
Cell therapies for cardiopathies: the shift of paradigms
Centre de Recherche en Myologie, Sorbonne Universités, UPMC-Inserm UMRS 974, CNRS FRE 3617, Institut de Myologie, Groupe Hospitalier Pitié-Salpêtrière, Paris, France
*
jt.vilquin@institut-myologie.org
L’insuffisance cardiaque est un problème majeur de santé publique et différentes approches de thérapie cellulaire sont expérimentées pour améliorer la fonction de myocardes défaillants. De nombreux types cellulaires ont été utilisés (myoblastes squelettiques, cellules hématopoïétiques, endothéliales ou mésenchymateuses, cellules d’origine cardiaque…), plus souvent dans des indications d’insuffisance post-ischémique que de cardiomyopathie dilatée génétique. Il est en effet plus aisé de cibler une zone de réparation localisée que l’ensemble du tissu myocardique. De nombreux essais cliniques ont fait état de résultats fonctionnels de faibles ampleurs mais encourageants, dont l’interprétation est souvent limitée par la taille des cohortes et les variabilités biologiques liées aux patients et aux candidats cellulaires. Ces essais ont aussi mis en lumière des mécanismes d’action inattendus, qui changent les concepts et méthodologies de traitement. En effet, les bénéfices proviendraient de sécrétions de facteurs trophiques, plutôt que d’une intégration structurale des cellules au sein du myocarde. Par conséquent, les nouvelles générations d’essais visent à accroître la taille et l’homogénéité des cohortes de patients afin d’améliorer la puissance statistique. Par ailleurs, des études misent sur l’accompagnement et/ou le conditionnement des cellules à l’aide de biomatériaux et/ou de cocktails de cytokines, en vue d’améliorer leur survie et leur fonctionnement. En parallèle, de nombreuses recherches en bio-ingénierie s’intéressent au soutien des cellules, au maintien de la structure du myocarde, à la fabrication ex vivo de tissu cardiaque de substitution, et finalement à la possibilité de remplacer les cellules par leurs produits actifs de sécrétion. Plusieurs dispositifs devraient émerger de ces recherches, dont le choix sera guidé par l’indication médicale.
Abstract
Heart failure is a major concern for public health systems, and several approaches of cellular therapy are being investigated with the goal of improving the function of these failing hearts. Many cell types have been used (skeletal myoblasts, hematopoietic, endothelial or mesenchymal progenitors, cardiac cells…), most often in the indication of post-ischemic heart failure rather than in the indication of genetic dilated cardiomyopathy. It is easier, indeed, to target a restricted area than the whole myocardium. Several clinical trials have reported slight but encouraging functional benefits, but their interpretations were frequently limited by the small sizes of cohorts, and by the biological variabilities inherent to the patients status and to the biology of the cells. These trials also shed light on unexpected mechanisms of action of the cells, which are changing the concepts and methodologies of the studies. The functional benefits observed would be due, indeed, to the secretion of trophic factors by the cells, instead of their true structural and mechanical integration within the myocardial tissue. Accordingly, the new generations of clinical trials aim at improving the size and homogeneity of the patient cohorts to increase the statistical power. On the other hand, several studies are associating or conditionning cells with biomaterials or cocktails of cytokines to improve their survival and their biological efficacy. In parallel, bio-engineering investigates several ways to support cells in vitro and in vivo, to sustain the architectural structure of the failing myocardium, to produce ex vivo some true substitutive cardiac tissue, or to purely replace the cells by their active secreted products. Several therapeutic devices should emerge from these researches, and the choice of their respective use will be ultimately guided by the medical indication.
© 2016 médecine/sciences – Inserm

Vignette (©safaravector/FOTOLIA.COM).
Epidémiologie, contexte médical et social
L’insuffisance cardiaque (IC) représente l’une des principales causes de morbidité et de mortalité au XXIe siècle dans les pays développés. En Europe, l’IC est responsable de 5 % des admissions hospitalières en urgence, et représente environ 10 % de l’occupation des lits. Le pronostic de cette maladie est sombre, puisqu’un patient sur cinq décèdera dans l’année suivant son diagnostic, et le taux de décès à 5 ans est de plus de 50 %. Ainsi, en France, près de 500 000 personnes présentent une insuffisance cardiaque, on dénombre environ 120 000 nouveaux cas et 32 000 décès chaque année, et les coûts représentent 1-2 % du total des dépenses de santé. Les approches pharmacologiques (inhibiteurs de l’enzyme de conversion, bêta-bloquants…), la revascularisation, la réadaptation cardiovasculaire ont considérablement amélioré ce pronostic, mais restent des traitements symptomatiques, et les échappements ne sont pas rares. La transplantation cardiaque, qui constitue une solution ultime, est limitée par le nombre réduit de donneurs. Les approches de thérapie génique n’ont pas apporté tous les résultats escomptés. Les dispositifs d’aide mécanique ont des indications restreintes, et les nouvelles technologies de cœurs implantables sont encore en cours de développement.
L’une des causes principales de l’IC est l’ischémie myocardique. L’hypoxie puis la réponse inflammatoire entraînent la perte rapide et irréversible des cardiomyocytes adultes. Il n’existe pas, dans le muscle cardiaque, un stock important de cellules souches réparatrices, à l’inverse de l’abondance des cellules satellites présentes dans les muscles squelettiques. C’est donc un tissu fibreux cicatriciel, non contractile, qui va remplacer progressivement des portions de myocarde, entraînant un remodelage local puis global, une baisse de la fonction contractile, un effondrement progressif de l’efficacité hémodynamique.
Les cardiomyopathies dilatées non ischémiques (CMD) sont également à l’origine d’IC réfractaires progressives. Elles sont définies par une dilatation des cavités ventriculaires associée à une altération de la fonction contractile du myocarde. Leur étiologie n’est pas toujours expliquée, mais une origine génétique peut être établie dans un nombre croissant de cas. Les gènes identifiés à ce jour codent des protéines structurales du cytosquelette ou du sarcolemme (myosines, actines, troponine T, desmine, sarcoglycans, lamines, dystrophine…) [1]. Certaines pathologies neuromusculaires sont associées à une atteinte cardiaque évoluant vers une forme de CMD accompagnée d’insuffisance cardiaque grave, responsable en définitive du décès du patient myopathe. Il existe moins d’options thérapeutiques pour les CMD que pour les pathologies d’origine ischémique. Les CMD constituent environ 50 % des indications de transplantation cardiaque, et sont associées à des taux élevés de morts subites par arythmies ventriculaires.
Les mécanismes endogènes de régénération ne sont pas suffisants pour assurer la réparation de myocardes massivement endommagés, et cette constatation a amené de nombreuses équipes à tenter des approches de médecine régénérative, visant à repeupler ou revitaliser par des cellules des zones myocardiques lésées. Ces approches sont actuellement essentiellement basées sur la thérapie cellulaire, elles visent à remplacer les tissus fibrosés par des équivalents possédant des propriétés plus élastiques, à restreindre le remodelage, à restaurer une contractilité myocardique, à augmenter l’angiogenèse, à améliorer les conditions de survie des cellules localement présentes, à moduler les réponses inflammatoires, ou à recruter des cellules progénitrices locales ou circulantes. Ces approches thérapeutiques sont donc basées sur la restauration de fonctions nécessaires aux patients, plutôt que focalisées sur un type cellulaire en particulier. Ceci explique que de nombreux types cellulaires ont été proposés pour remplir ces offices, mais dont la pertinence clinique ultime a souvent été limitée par le manque de caractérisation phénotypique, les difficultés d’obtention, d’expansion, d’administration ciblée, d’intégration au sein du tissu cardiaque, et finalement le manque d’efficacité biologique avérée in vivo (Figure 1).
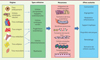 |
Figure 1. Types cellulaires testés en clinique, mécanismes discutés, et effets recherchés. |
L’indication clinique peut dicter le choix d’un type cellulaire, ou d’un contexte immunologique. Ainsi un traitement préventif de l’IC en phase aiguë de l’ischémie myocardique fera appel à des cellules rapidement mobilisables, ne nécessitant pas de longs délais de cultures. Les traitements en phase chronique permettent l’utilisation de nombreux types cellulaires. Les approches autologues sont théoriquement préférées afin d’éviter les risques de rejet immunologique et de limiter les risques bactério-virologiques, mais les approches allogéniques ont pris progressivement une place importante dans cet arsenal. De nombreux essais cliniques sont en cours, soulignant encore, pour l’instant, l’absence de consensus quant au choix d’un candidat idéal.
Types cellulaires envisagés et/ou utilisés
Les cardiomyocytes
Dans des modèles animaux, le transfert de cardiomyocytes fœtaux permet une reconstitution histologique et fonctionnelle de la zone nécrosée. Cependant, l’extraction directe de cardiomyocytes adultes est très difficile, leur capacité proliférative et d’intégration disparaît très peu de temps après la naissance chez les mammifères, et cette source de cellules n’est donc pas utilisable dans des perspectives cliniques.
Les cellules souches cardiaques
Plusieurs équipes ont identifié indépendamment de petits nombres de cellules souches cardiaques, présentes dans le myocarde, et dont les phénotypes peuvent varier d’une étude à l’autre. Un turn-over des cellules cardiaques existe en effet, mais il est extrêmement faible.
Des cellules responsables de la cardiomyogénèse ont été identifiées chez l’embryon et le jeune animal par l’expression du gène Islet1. Ces cellules sont impliquées dans la formation du champ secondaire cardiaque, du tissu de conduction, et du tissu vasculaire lors du développement [2]. Elles peuvent être multipliées in vitro sur un substrat d’origine cardiaque, pour se différencier en cardiomyocytes fonctionnels. Cependant, cette population présente une hétérogénéité phénotypique et fonctionnelle, sa localisation anatomique empêche son prélèvement chez le patient selon une modalité autologue.
Les populations de cellules c-Kit+ présenteraient une fréquence de 1/10 000 et reconstitueraient les myocardes endommagés en participant à la fois à l’angiogenèse et à la cardiogénèse. Il est difficile de les produire rapidement et en grand nombre, et leurs caractéristiques phénotypiques ne sont pas conservées en culture. Elles ont fait l’objet de nombreuses controverses : leur rôle dans la cardiogenèse serait très minoritaire [3] et un essai clinique les utilisant a fait l’objet d’une enquête.
Les populations de cellules Sca-1+ représenteraient jusqu’à 20 % des cellules non contractiles du myocarde, certaines peuvent se différencier en cardiomyocytes, cependant le marqueur Sca-1 est essentiellement murin et son équivalent humain est encore énigmatique. Dans la plupart des cas, leur différenciation cardiaque est tributaire d’un environnement cellulaire cardiaque.
Les mésangioblastes sont une catégorie de péricytes ou de cellules périvasculaires et ont été décrites dans des compartiments cardiaques, mais ont surtout été étudiées dans le contexte de la régénération musculaire squelettique.
Il est possible de produire à partir de tissu cardiaque adulte des structures cellulaires appelées cardiosphères. Ces amas, issus de cultures réalisées dans des conditions particulières, contiennent des cellules présentant des caractéristiques proto-cardiogéniques, mais surtout mésenchymateuses si l’on se fonde sur les marqueurs qu’elles expriment préférentiellement. Les propriétés essentiellement trophiques de ces cellules ont été mises à profit au cours d’essais cliniques.
Il existe également, au sein du cœur adulte et en particulier au niveau des oreillettes, des populations de cellules exprimant des enzymes de la famille des aldéhydes déshydrogénases. Ces populations sont impliquées dans la détoxification des aldéhydes, favorisant la survie cellulaire en conditions hostiles, mais aussi dans le métabolisme de l’acide rétinoïque, un acteur majeur des différenciations myogéniques et cardiogéniques [4, 5, 6]. Ces populations cellulaires, cependant, expriment surtout des phénotypes mésenchymateux, mais améliorent la fonction cardiaque dans des modèles animaux.
Les cellules souches hématopoïétiques
Ces cellules progénitrices peuvent être obtenues en quantités importantes à partir de biopsies médullaires (crête iliaque) ou de sang périphérique. La rapidité de préparation et la relative facilité d’obtention, au chevet du patient, ont motivé leur utilisation dans de nombreux protocoles cliniques. Cependant, plusieurs études ont établi la restriction de différenciation de ces cellules vers la voie hématopoïétique, et les modestes bénéfices fonctionnels observés sont attribués à des mécanismes paracrines. Des cellules hématopoïétiques peuvent être mobilisées par le G-CSF pour une récupération dans le sang circulant. Le sang de cordon, qui peut être préparé à l’issue d’accouchements, est également considéré actuellement comme une source potentielle intéressante pour ses nombreuses composantes, les cellules hématopoïétiques, endothéliales, et mésenchymateuses.
Les cellules souches mésenchymateuses (CSM)
Ces cellules ont été décrites à partir du compartiment médullaire, mais peuvent être obtenues à partir d’autres tissus. En particulier, une fraction stromale du tissu adipeux, abondant et facile d’accès, contient également des cellules proches des CSM qui présentent des capacités angiogéniques plus marquées. Les CSM ont des capacités de différenciation établies, qui ont suscité des études très avancées de leur potentiel régénératif (formation d’os ou de cartilage), et des capacités plus controversées ont été revendiquées (participation à l’angiogénèse, à la myogénèse, à la cardiogénèse). Elles sont également étudiées et utilisées pour leurs propriétés immunomodulatrices, dont les mécanismes commencent à être élucidés. Enfin, lorsqu’elles ne se différencient pas de manière terminale, elles participent au soutien stromal, en sécrétant des facteurs trophiques de différentes natures (cytokines, protéines, ARNs), solubles ou contenus dans des microvésicules [7]. Cependant, leur utilisation directe pour la réparation cardiaque dans des modèles animaux s’est parfois heurtée à la formation de tissus osseux ectopiques, et au risque de micro-embolisation lorsqu’elles sont injectées par la voie coronaire.
Une nouvelle modalité d’utilisation de ces cellules a donc été développée, basée sur l’engagement cardiogénique avant injection. La différenciation des cellules cardiaques passe par différente étapes, au cours de la cardiogenèse, et ces étapes ont été décortiquées et modélisées in vitro. Des progéniteurs mésodermiques embryonnaires forment un mésoderme cardiaque, puis des progéniteurs cardiaques, puis des cardiomyocytes immatures, enfin des cardiomyocytes terminaux, mettant en œuvre plus de 25 gènes. Parmi ceux-ci, GATA4, NKx2.5 et Tbx5 ont des schémas d’expression caractéristiques, et leur induction a été testée à l’aide de nombreuses molécules. Ces recherches ont identifié des cocktails (activateurs et inhibiteurs de la voie wnt, protéines BMP, FGF, IGF1) qui, utilisés de manière séquentielle, permettent de produire des progéniteurs cardiaques immatures, à partir de CSM (Figure 2).
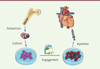 |
Figure 2. Conditionnement moléculaire des cellules avant utilisation. |
Cette approche d’un conditionnement des CSM in vitro est à l’origine de nouveaux essais cliniques [8] mais l’échec récemment rapporté de l’essai randomisé (CHART-1) qui a évalué ces CSM « cardiopoïétiques » pose la question de leur réelle efficacité.
Les cellules endothéliales
L’utilisation de précurseurs endothéliaux a été proposée dans le but d’augmenter l’angiogenèse locale ou de soutenir d’autres types cellulaires greffés en parallèle. Les progéniteurs endothéliaux peuvent être préparés à partir de moelle osseuse, de sang périphérique, et des méthodologies ont été développées pour les multiplier en culture. Elles sont très étudiées, en thérapie cellulaire, principalement pour le traitement de pathologies vasculaires telles que l’ischémie de membre inférieur liée au diabète.
Les myoblastes
L’utilisation des myoblastes a initialement reposé sur leurs capacités à former, in situ, du tissu musculaire squelettique fonctionnel. Ces cellules sont obtenues en grandes quantités à partir de biopsies musculaires, par expansion des cellules satellites qui sont les cellules souches résidentes des muscles squelettiques. Leur utilisation dans diverses indications d’IC s’est traduite par des bénéfices fonctionnels mitigés et transitoires, médiés par des mécanismes paracrines mais non structuraux.
Les cellules souches embryonnaires (ES)
Ces cellules pluripotentes peuvent, a priori, se différencier dans la plupart des types cellulaires d’un organisme. Leur différenciation en cardiomyocytes est de mieux en mieux maîtrisée. Les rendements de différenciation et la maturation pourront être encore améliorés en combinant des substrats synthétiques, un conditionnement par des contraintes mécaniques, ou la stimulation électrique. Les cellules ES engagées présentent des caractéristiques biochimiques et électrophysiologiques proches de celles de cardiomyocytes adultes. Dans des modèles d’IC post-ischémique, incluant les primates non humains, des cellules implantées en zone cicatricielle se différencient en cardiomyocytes et participent à la régénération histologique et fonctionnelle de l’organe [9]. Cependant, l’efficacité de ce type cellulaire peut être liée à l’indication, donc à l’environnement tissulaire où ces cellules sont implantées. L’intégration peut être très mauvaise, dans des modèles de CMD génétique, où le tissu cardiaque reste compact [10]. Sur le plan clinique, l’utilisation des cellules ES peut être limitée par plusieurs aspects : la possibilité de séparer, avec un très haut rendement et une très haute spécificité, les cellules prédifférenciées, afin de parer à la formation de tissus tumoraux ; le caractère immunogène à présent bien reconnu de ces cellules [11] qui sont forcément utilisées dans un contexte allogénique ; dans certains cas, des considérations éthiques liées à l’obtention et à la préparation de lignées humaines ; leur capacité de maturation terminale in vivo.
L’utilisation de ces cellules dans un contexte clinique est donc conditionnée par une série d’étapes et de contraintes à respecter pour garantir la sécurité des patients. Une banque de cellules doit être constituée, standardisée, et les caractéristiques des cellules doivent en être validées. À partir de celles-ci, une spécification cardiaque doit être mise en œuvre, et également validée. Puis, une purification poussée des cellules cardiogéniques doit être réalisée, dans le but d’éliminer les cellules non engagées et susceptibles de différenciations non souhaitées. Enfin, il ne faut pas sous-évaluer la variabilité biologique et des réactifs [12–15]. La validation de ces étapes est réalisée en concertation avec les agences réglementaires. Ces obstacles ont été récemment surmontés, ce qui a permis le lancement d’un nouveau type d’essai clinique, appelé ESCORT, évoqué ci-après.
Les cellules souches induites pluripotentes (cellules iPS) suscitent un grand intérêt car elles peuvent être obtenues par l’introduction d’une série de gènes à l’intérieur de cellules somatiques adultes, c’est-à-dire dans un contexte potentiellement autologue. Ainsi reprogrammées, elles présentent un grand nombre des caractéristiques des cellules ES, notamment la capacité de différenciation cardiomyogénique. Le développement de ces cellules en est encore à ses débuts mais les résultats sont prometteurs chez le primate non-humain. Des progrès sont réalisés concernant la nature des reprogrammations (pour éviter des évènements d’intégration de séquences proto-oncogènes) et leur différenciation terminale, mais leur stabilité doit être contrôlée avant une utilisation clinique.
Mécanismes d’action des candidats cellulaires
Les concepts liés aux mécanismes d’action des cellules proposées ont évolué, avec les mesures de leur efficacité, de leur survie et de leur capacité d’intégration… Initialement, ces cellules étaient supposées apporter un bénéfice structural, contractile, et dans certains cas la différenciation directe en cardiomyocytes intégrés au tissu cardiaque était espérée. De nombreuses études ont mis en évidence des améliorations modestes de l’efficacité contractile, mais il est apparu que ces bénéfices étaient vraisemblablement liés à des effets de sécrétions paracrines. La production de cytokines, de facteurs de croissance, d’exosomes et de microparticules stimule l’angiogenèse locale, diminue l’apoptose, l’inflammation, la fibrose et le remodelage, mais la formation de nombreux vrais cardiomyocytes n’a été obtenue qu’à partir de cellules ES engagées. La plupart des types cellulaires envisagés joue donc essentiellement un rôle trophique et de soutien [16].
Les exosomes sont des particules de 30 à 100 nm, les microvésicules mesurent de 100 à 1 000 nm. Tous deux contiennent des protéines, des lipides, du matériel génétique, différents miARN, et sont libérés par de nombreux types cellulaires incluant les cellules ES, les iPS, les CSM, les myoblastes, notamment après activation. Captés par les cellules, ils leur apportent des informations, et font ainsi partie d’un réseau de communications intercellulaires. Des études ont montré que ces vésicules amélioraient à elles seules la fonction cardiaque, l’angiogénèse locale, la survie des cellules ; ces effets sont médiés en partie par des miARN [17, 18]. Les vésicules produites par des cellules engagées dans la cardiogenèse (cardiosphères, cellules iPS et ES induites) sont plus efficaces que celles produites par des cellules engagées dans d’autres voies (fibroblastes) (Figure 3).
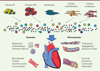 |
Figure 3. Productions cellulaires paracrines et effets sur l’homéostasie cardiaque. |
La compréhension des mécanismes d’action n’est pas sans importance pour la mise en œuvre de nouvelles stratégies, et peut entraîner un changement du paradigme de traitement [16]. En effet, si les cellules ne s’intègrent pas, il peut être possible d’utiliser indifféremment des cellules autologues et allogéniques. Et si les cellules n’agissent que par leurs sécrétions, peut-être peut-on se passer des cellules pour n’utiliser que les sécrétions ?
Essais cliniques
De nombreux essais cliniques ont été réalisés depuis une quinzaine d’années, essentiellement dans les indications de l’IC post-ischémique, utilisant différents types cellulaires, et sous la promotion d’acteurs académiques ou privés. Les essais ouverts de phase I ont généralement fourni des résultats très enthousiasmants, des essais de phase II leur ont succédé et se sont conclus par des résultats mitigés. Plusieurs types cellulaires, dans différentes indications, font actuellement l’objet d’essais de phase III. Plusieurs milliers de patients ont été inclus, donnant lieu à de très nombreuses études.
Ainsi, pour ne citer que les essais à grands effectifs, l’efficacité des CSM (d’origine médullaire ou adipeuse) a été éprouvée au cours des essais APOLLO, C-Cure, CHART I, MESAD, POSEIDON, PRECISE, PROMETHEUS, REGENT, RENEW, SEED-MSC, STROMACELL, TRIDENT… Les cellules d’origine médullaire ont été testées au cours des essais ASTAMI, BAMI (en cours), BONAMI, BOOST, FOCUS, FINCELL, HEBE, REPAIR-AMI, TAC-HFT… Les cellules d’origine cardiaque (cardiosphères, cellules c-kit+) ont été testées dans les essais ALCADIA, DYNAMIC, CADUCEUS, SCIPIO, TICAP. Les myoblastes ont fait principalement l’objet de l’essai MAGIC [19].
Des méta-analyses, dédiées à des indications, à des types cellulaires ou à des voies d’administrations particuliers, ont été menées, regroupant parfois plus de 40 études et plus de 2 500 patients [20–23]. Ces analyses, globalement, notent une absence d’augmentation de la surmortalité des patients, mais aussi (et pas toujours) une légère amélioration de la fraction d’éjection du ventricule gauche (de 2.5 à 5.5 % selon les études) et une limitation du remodelage, une amélioration variable de la qualité de vie des patients. Elles donnent aussi des résultats contradictoires, suggérant des bénéfices seulement dans certaines indications (différenciant par exemple l’indication d’ischémie chronique de la situation d’infarctus aigu). Généralement, ces analyses mettent en évidence de grandes hétérogénéités entre les essais, les cohortes, les méthodologies d’inclusion et de mesures, et elles soulignent la nécessité de réaliser des cohortes plus larges, plus homogènes, et, idéalement, randomisées. De manière plus inquiétante, l’étude DAMASCENE [24] établit une corrélation positive entre les biais relevés par une lecture attentive, et l’efficacité revendiquée, et plaide pour une rigueur accrue.
L’applicabilité, la pertinence thérapeutique de ces approches sont beaucoup moins explorées dans les indications d’IC non-ischémique pour des raisons conceptuelles, médicales et techniques. La nature progressive de ces atteintes, l’extension de la fibrose et du remodelage, rendent le ciblage d’une zone spécifique plus difficile que lorsqu’il s’agit d’une cicatrice d’ischémie clairement délimitée. Alors qu’il est relativement aisé de créer des modèles expérimentaux d’IC post-ischémique par des ligatures coronaires chirurgicales, peu de modèles pertinents ont été développés qui miment la physiopathologie des CMD non ischémiques. Enfin, les mécanismes thérapeutiques à l’œuvre dans les indications ischémiques ne sont pas forcément les mêmes que dans les CMD non-ischémiques. Une synthèse récente [25] répertorie une quinzaine d’études cliniques de différentes envergures. La plupart rapportent une amélioration de la fraction d’éjection ventriculaire gauche (de 3 à 11 %), une amélioration des scores cliniques et de la qualité de vie des patients, une absence d’effet sur la surmortalité, mais une incidence plus élevée de troubles rythmiques. Ici encore, de fortes hétérogénéités sont notées concernant les critères d’inclusion, les procédures, les mesures. Plusieurs essais sont en cours : ALLSTAR, IMPACT-DCM, ixCELDCM, MiHeart, NOGA-DCM, POSEIDON-DCM, REGENERATE-DCM, Revascor…
De manière générale, l’hétérogénéité des études est liée notamment à la variabilité présentée par des patients ayant des caractéristiques et des parcours de vie différents : citons les co-morbidités associées, le degré de sédentarité, le genre, l’âge, la présence d’un tabagisme, la nature des lésions myocardiques, les traitements pharmacologiques associés… L’hétérogénéité peut aussi être liée aux cellules puisque le nombre de cellules disponibles, leur physiologie et leur activité, la nature de la délivrance, le nombre de doses… peuvent varier. Il sera nécessaire dans l’avenir de constituer des cohortes de patients plus importantes, et plus homogènes tant du point de vue de l’indication et des qualités des types cellulaires, que du point de vue de l’état physiologique des patients.
Quel modèle immunologique, quel modèle économique ?
Le développement de traitements ne peut échapper à une étude des modèles économiques qui pourraient être mis en œuvre pour en assurer une dissémination [26]. En plus des acteurs académiques, de certaines grandes institutions ou de grands hôpitaux, de nombreuses compagnies privées sont ou se sont impliquées dans ces recherches de thérapie cellulaire de l’IC ; citons par exemple : Aastrom, Aldagen, Amorcyte, Angioblast, Arteriocyte, Baxter, Biocardia, Bioheart, Caprico, Celyad, Cytori, Genzyme, Harvest-Tech, Miltenyi, Osiris, Stempeutics, TCA, Teva Pharmaceuticals, Theravitae…
Le point le plus délicat est représenté par la production de cellules de qualité clinique. Le coût de production est lié au nombre d’étapes et à la quantité de matériels et réactifs nécessaires à la réalisation et à la validation d’un lot. Le risque, et sa maîtrise, son liés au nombre de lots produits par unité de temps. On peut donc opposer deux stratégies basées sur l’utilisation de cellules allogéniques, ou de cellules autologues.
Les cellules allogéniques sont produites à partir d’un ou plusieurs donneurs sains, définis par certains critères (âge, état de santé, activité et disponibilité des cellules…). Les cellules sont produites à grande échelle et constituent un lot unique faisant l’objet des contrôles de qualité. Puis elles sont conservées en petits aliquotes, et utilisées au moment des besoins. Une production peut suffire à plusieurs centaines de patients, et la production à grande échelle est économique sur le plan des réactifs et des installations. Le différentiel de coût devient très intéressant, par rapport au coût de production de cellules autologues, lorsque le nombre de patients à traiter dépasse les 200 000 [26]. Cependant, les cellules allogéniques sont, par définition, immunogènes pour le receveur, qui devra recevoir une immunosuppression coûteuse et risquée pour en éviter le rejet. Si la persistance des cellules n’est pas recherchée à long terme, mais seulement pour un temps correspondant à la synthèse de facteurs à effet paracrine, l’immunosuppression pourra être plus limitée, et par conséquent mieux tolérée. Le développement d’une sensibilisation immunitaire du receveur, lors de la première injection, empêche les possibilités de ré-administration ultérieure des mêmes cellules allogéniques (un lot provenant d’un donneur différent pourrait théoriquement être utilisé).
Les cellules autologues sont produites à partir du donneur lui-même. Selon le type cellulaire considéré, la préparation peut prendre plus ou moins de temps, et de longues cultures cellulaires ne peuvent être entreprises si le traitement doit être réalisé très rapidement. Chaque production est donc considérée comme un lot indépendant, qui doit être qualifié individuellement, et dont la qualité intrinsèque dépend de chaque donneur. Les risques sont augmentés, ainsi que les difficultés logistiques et les coûts. Dans un certain nombre de cas, les productions peuvent échouer pour des raisons inhérentes aux patients ou à la qualité de leurs cellules. L’avantage de l’approche autologue est qu’elle évite les risques de rejet, et donc à la fois les coûts et les risques liés à l’immunosuppression, tout en permettant les ré-administrations des mêmes cellules en cas de nécessité. L’approche autologue est donc intéressante dans le cas où les cellules sont administrées plusieurs fois, justifiant la production en grandes quantités et générant des économies d’échelle.
Des études précliniques et cliniques récentes suggèrent une efficacité clinique comparable des CSM autologues et allogéniques [27, 28]. S’il s’avère qu’un effet transitoire est suffisant, les cellules allogéniques pourraient prendre le dessus sur les applications autologues pour des questions de coût et de simplicité de mise en œuvre. Nous verrons un peu plus loin qu’il est même possible, dans l’avenir, que la présence-même des cellules ne soit pas une condition absolue… ce qui changerait tout à fait le paradigme de préparation de ces produits biologiques.
Délivrance des cellules, biomatériaux, et suivi des cellules
Outre les questions biologiques, la thérapie cellulaire se heurte à des questions de délivrance des cellules. La technique de transfert de cellules la plus utilisée jusqu’à présent repose sur des injections en des sites multiples directement dans une zone ciblée plus ou moins étendue (Figure 4).
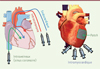 |
Figure 4. Modalités de délivrance des cellules. |
L’injection peut être faite manuellement de manière sous-épicardique, ou à l’aide de cathéters empruntant la voie intra-coronaire ou endocardique (plus exceptionnellement, la voie rétrograde du sinus coronaire). Cette modalité d’administration n’est pas tout à fait satisfaisante pour plusieurs raisons : elle implique d’abord une trypsination des cellules qui les prive de leur ancrage naturel à une matrice ; elle projette les cellules sous pression, et sans protection dans un environnement qui n’est pas nécessairement favorable à leur intégration ; elle est peu précise et difficilement reproductible ; elle conduit à une dissémination de foyers intra-myocardiques potentiellement arythmogènes. Alternativement, les cellules peuvent être injectées dans la circulation cardiaque via un cathéter intra-coronaire, bloqué temporairement par un ballonnet gonflable. Cette technique ne permet aux cellules injectées qu’un temps de passage bref dans la circulation et leur réelle rétention est mal connue.
L’utilisation de biomatériaux s’impose progressivement en adjonction de cellules nues [14, 15]. Les biomatériaux « habillent » les cellules ; ils peuvent les protéger contre les effets de flux à l’injection ; ils augmentent la survie et la rétention précoce en fonction de leurs paramètres physico-chimiques ; ils peuvent mimer un environnement 3D à type de niche, et certains peuvent être fonctionnalisés par des facteurs de croissance ; ils peuvent renforcer la structure même des parois ou du myocarde en fonction de leurs propriétés physiques. Les différents types de biomatériaux sont les polymères naturels, les polymères synthétiques, les tissus décellularisés, voire les feuillets cellulaires (simples ou multiples) où les cellules se soutiennent mutuellement et se complètent fonctionnellement (Jackman, 2015). Les biomatériaux présentent différentes caractéristiques sur lesquelles il est possible de jouer selon la nécessité biologique, ou l’utilisation envisagée : structure (porosité ; géométrie du réseau ; fonctionnalisation ; dégradation) ; élasticité ; capacité d’induction angiogénique ou cardiogénique ; état physique (liquide, visqueux, semi-solide…).
Plusieurs équipes expérimentent l’application sur les zones pathologiques cibles des feuilles de cellules, ou de matrices cellularisées biodégradables à base d’alginates, de Matrigel, de fibrine, de polysaccharides, de gélatine, de collagène, dans différentes espèces animales (Souris, Rat, Cochon d’Inde, Mouton, Macaque) [29]. Certaines matrices favorisent la survie cellulaire et promeuvent l’angiogénèse locale, et dans des modèles post-ischémiques, ces greffons améliorent la fonction cardiaque [30, 31]. Des progrès restent à accomplir concernant l’intégration réelle de ces biomatériaux, leur vascularisation, leur colonisation par des cellules de l’hôte, et réciproquement la migration des cellules qu’elles contiennent vers le tissu cardiaque hôte. Ces résultats fondent l’utilisation de matrices biodégradables. Certains biomatériaux peuvent aussi être utilisés ex vivo pour participer à la production de tissu cardiaque, qui pourra être ensuite implanté directement sur la zone à traiter [32]. Lors de leur conception, il ne faut cependant pas négliger le côté pratique de leur utilisation, pour le médecin qui sera amené à les mettre en place.
Des techniques d’imagerie cellulaire ont été développées, ou mises à profit, pour suivre le destin de ces cellules que l’on voudrait promises à un engagement cardiaque [33]. Prises dans un état de flux permanent, il faut pouvoir en suivre l’état, le phénotype, l’activité, la migration, la différenciation ou la fonction in vitro et in vivo. Ces méthodes sont souvent complémentaires, directes ou indirectes, soit pour leurs hautes résolutions mises en œuvre dans les caractérisations in vitro (microscopie confocale, à deux photons, à super-résolution, analyse de seconde harmonique, spectroscopie Raman, imagerie photo-acoustique…), soit pour leurs capacités d’investigations de tissus épais mises en œuvre pour le suivi dans l’animal vivant (imagerie bioluminescente, imagerie par résonance magnétique ou tomographie par émission de positons, microscopie multimodale, tomographie à cohérence optique…) [33].
Vers des changements de paradigme ?
Trois constatations majeures, issues de l’expérimentation et des observations, commencent à s’imposer, et pourraient amener à changer progressivement de paradigme et de méthodologies : (1) dans de nombreuses études, l’effet bénéfique de l’injection des cellules persiste en dépit du faible nombre de cellules survivantes, en dépit de leur disparition ou de leur absence d’intégration ; cependant, les cellules qui présentent un réel phénotype cardiaque, une réelle capacité d’intégration, sont plus performantes ; (2) l’utilisation de biomatériaux, chez l’animal, peut améliorer la survie, la rétention et l’efficacité des cellules, et même certains biomatériaux sans cellules peuvent se révéler efficaces ; (3) enfin, les cellules libèrent des exosomes et des microvésicules qui contiennent de très nombreux composés de différentes natures capables d’interagir ensemble ou de se compléter, et qui sont probablement à l’origine de tout ou partie des bénéfices observés.
Une nouvelle catégorie d’essai a été initiée récemment. Dans l’essai ESCORT de phase I, des cellules ES engagées dans la différenciation cardiogénique et sélectionnées sur cet engagement ont été incluses dans un gel de fibrine. Au cours d’une opération de pontage coronaire, cette pièce de biomatériel a été fixée en regard de la zone d’infarctus, puis recouverte et immobilisée par un lambeau du péricarde entrouvert du patient. Cette méthode permet de maintenir la pièce en place, et il permet également de la nicher au sein de tissus vascularisés (Figure 5). Les cellules étant allogéniques, les patients reçoivent une immunosuppression transitoire stoppée au bout d’un mois. Les premiers patients ont été inclus dans cet essai, destiné avant tout à évaluer la tolérance et la sécurité des procédures et matériels, et il se déroule à ce jour sans incident [12, 13]. Cet essai est donc particulièrement innovant, car il repose sur l’utilisation de cellules pluripotentes spécifiées et sélectionnées, en combinaison avec un biomatériau, et il mise autant, sinon davantage, sur la production de facteurs à activité paracrine par les cellules que sur leur intégration structurale au myocarde.
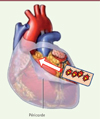 |
Figure 5. Mise en place sous-péricardique d’un biomatériau. |
S’il s’avère que les exosomes et microvésicules produits par des cellules engagées sont capables d’améliorer la fonction cardiaque, il pourra être légitime de vouloir substituer l’administration de cellules par l’injection de microvésicules purifiées. Celles-ci pourraient améliorer, temporairement, l’efficacité cardiaque, et l’on pourrait évoquer une stratégie thérapeutique « cell-based, cell-free » [14, 15]. Cependant, les bénéfices en seraient probablement transitoires, et nécessiteraient des injections répétées. L’utilisation de biomatériaux pourrait permettre une rétention prolongée de ces microvésicules au site de greffe. Une alternative consisterait à continuer d’utiliser des cellules, qui seraient choisies et sélectionnées pour leur capacité de production continue des vésicules les plus efficaces, et qui seraient implantées au titre de petites centrales de production.
Conclusions
Ces approches de médecine régénérative cardiaque ont été développées, chez l’homme, depuis une quinzaine d’années, à partir de concepts simples. De nombreux candidats de thérapie cellulaire ont été testés, avec des résultats mitigés, et il n’existe pas encore de consensus quant au type cellulaire préférentiel. Une compréhension plus fine des mécanismes d’action, le suivi des cellules, le développement de biomatériaux, permettent de progresser rapidement tous azimuts et de développer des concepts puis des approches innovantes. Un corollaire important de ces travaux dédiés à la santé humaine, est qu’ils permettent aussi une évolution rapide de la compréhension de la physiologie, de la biologie des cellules souches musculaires et cardiaques, et de la régénération musculaire, et qu’ils entraînent le développement de nouveaux outils. La prudence reste nécessaire, face aux incertitudes et aux variabilités de la biologie, aux risques d’erreurs et de mauvaises interprétations, aux excès d’enthousiasme. Les perspectives sont riches et nombreuses, la régénération ou au moins la préservation myocardiques restent des objectifs raisonnables.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les auteurs souhaitent remercier particulièrement le Professeur Philippe Menasché pour ses conseils, recommandations, et relectures attentives de ce manuscrit, ainsi que Madame Tuy Nga Brignol pour son aide et ses conseils iconographiques.
Références
- Charron P, Arad M, Arbustini E, et al. Genetic counselling and testing in cardiomyopathies: a position statement of the European Society of Cardiology working group on myocardial and pericardial diseases. Eur Heart J 2010 ; 31 : 2715–2726. [CrossRef] [PubMed] [Google Scholar]
- Moretti A, Caron L, Nakano A, et al. Multipotent embryonic isl1+ progenitor cells lead to cardiac, smooth muscle, and endothelial cell diversification. Cell 2006 ; 127 : 1151–1165. [CrossRef] [PubMed] [Google Scholar]
- Van Berlo JH, Molkentin JD. Most of the dust has settled: cKit+ progenitor cells are an irrelevant source of cardiac myocytes in vivo. Circ Res 2016 ; 118 : 17–19. [CrossRef] [PubMed] [Google Scholar]
- Balber AE. Concise review: aldehyde dehydrogenase bright stem and progenitor cell populations from normal tissues: characteristics, activities, and emerging uses in regenerative medicine. Stem Cells 2011 ; 29 : 570–575. [CrossRef] [PubMed] [Google Scholar]
- Koninckx R, Daniels A, Windmolders S, et al. The cardiac atrial appendage stem cell: a new and promising candidate for myocardial repair. Cardiovasc Res 2013 ; 97 : 413–423. [CrossRef] [PubMed] [Google Scholar]
- Roehrich ME, Spicher A, Milano G, et al. Characterization of cardiac-resident progenitor cells expressing high aldehyde dehydrogenase activity. Biomed Res Int 2013 ; 2013 : 503047. [CrossRef] [PubMed] [Google Scholar]
- Karantalis V, Hare JM. Use of mesenchymal stem cells for therapy of cardiac disease. Circ Res 2015 ; 116 : 1413–1430. [CrossRef] [PubMed] [Google Scholar]
- Bartunek J, Behfar A, Dolatabadi D, et al. Cardiopoietic stem cell therapy in heart failure: the C-CURE (Cardiopoietic stem Cell therapy in heart failURE) multicenter randomized trial with lineage-specified biologics. J Am Coll Cardiol 2013 ; 61 : 2329–2338. [CrossRef] [PubMed] [Google Scholar]
- Chong JJ, Yang X, Don CW, et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature 2014 ; 510 : 273–277. [CrossRef] [PubMed] [Google Scholar]
- Catelain C, Riveron S, Papadopoulos A, et al. Myoblasts and embryonic stem cells differentially engraft in a mouse model of genetic dilated cardiomyopathy. Mol Ther 2013 ; 21 : 1064–1075. [CrossRef] [PubMed] [Google Scholar]
- Nussbaum J, Minami E, Laflamme MA, et al. Transplantation of undifferentiated murine embryonic stem cells in the heart: teratoma formation and immune response. FASEB J 2007 ; 21 : 1345–1357. [CrossRef] [PubMed] [Google Scholar]
- Menasché P, Vanneaux V, Fabreguettes JR, et al. Towards a clinical use of human embryonic stem cell-derived cardiac progenitors: a translational experience. Eur Heart J 2015 ; 36 : 743–750. [CrossRef] [PubMed] [Google Scholar]
- Menasché P, Vanneaux V, Hagège A, et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. Eur Heart J 2015 ; 36 : 2011–2017. [CrossRef] [PubMed] [Google Scholar]
- Menasché P. The future of stem cells: should we keep the stem and skip the cells?. J Thorac Cardiovasc Surg 2016 ; 152 : 345–349. [CrossRef] [PubMed] [Google Scholar]
- Menasché P, Vanneaux V. Stem cells for the treatment of heart failure. Curr Res Transl Med 2016 ; 64 : 97–106. [CrossRef] [PubMed] [Google Scholar]
- Silvestre JS, Menasché P. The evolution of the stem cell theory for heart failure. EBioMedicine 2015 ; 2 : 1871–1879. [CrossRef] [PubMed] [Google Scholar]
- Bobis-Wozowicz S, Kmiotek K, Sekula M, et al. Human induced pluripotent stem cell-derived microvesicles transmit RNAs and proteins to recipient mature heart cells modulating cell fate and behavior. Stem Cells 2015 ; 33 : 2748–2761. [CrossRef] [PubMed] [Google Scholar]
- Ibrahim AG, Cheng K, Marbán E. Exosomes as critical agents of cardiac regeneration triggered by cell therapy. Stem Cell Reports 2014 ; 2 : 606–619. [CrossRef] [PubMed] [Google Scholar]
- Menasché P, Alfieri O, Janssens S, et al. The myoblast autologous grafting in ischemic cardiomyopathy (MAGIC) trial: first randomized placebo-controlled study of myoblast transplantation. Circulation 2008 ; 117 : 1189–1200. [CrossRef] [PubMed] [Google Scholar]
- Fisher SA, Doree C, Mathur A, et al. Meta-analysis of cell therapy trials for patients with heart failure. Circ Res 2015 ; 116 : 1361–1377. [CrossRef] [PubMed] [Google Scholar]
- Harvey E, Fisher SA, Doree C, et al. Current evidence of the efficacy of cell-based therapies in heart failure. Circ J 2015 ; 79 : 229–236. [CrossRef] [PubMed] [Google Scholar]
- Kandala J, Upadhyay GA, Pokushalov E, et al. Meta-analysis of stem cell therapy in chronic ischemic cardiomyopathy. Am J Cardiol 2013 ; 112 : 217–225. [CrossRef] [PubMed] [Google Scholar]
- Sanganalmath SK, Bolli R. Cell therapy for heart failure: a comprehensive overview of experimental and clinical studies, current challenges, and future directions. Circ Res 2013 ; 113 : 810–834. [CrossRef] [PubMed] [Google Scholar]
- Nowbar AN, Mielewczik M, Karavassilis M, et al. DAMASCENE writing group. Discrepancies in autologous bone marrow stem cell trials and enhancement of ejection fraction (DAMASCENE): weighted regression and meta-analysis. Br Med J 2014 ; 348 : g2688. [CrossRef] [PubMed] [Google Scholar]
- Gho JM, Kummeling GJ, Koudstaal S, et al. Cell therapy, a novel remedy for dilated cardiomyopathy? A systematic review. J Card Fail 2013 ; 19 : 494–502. [Google Scholar]
- Smith DM. Assessing commercial opportunities for autologous and allogeneic cell-based products. Regen Med 2012 ; 7 : 721–732. [CrossRef] [PubMed] [Google Scholar]
- Hare JM, Fishman JE, Gerstenblith G, et al. Comparison of allogeneic vs autologous bone marrow–derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy: the POSEIDON randomized trial. JAMA 2012 ; 308 : 2369–2379. [CrossRef] [PubMed] [Google Scholar]
- Jansen Of Lorkeers SJ, Eding JE, Vesterinen HM, et al. Similar effect of autologous and allogeneic cell therapy for ischemic heart disease: systematic review and meta-analysis of large animal studies. Circ Res 2015 ; 116 : 80–86. [CrossRef] [PubMed] [Google Scholar]
- Jackman CP, Shadrin IY, Carlson AL, et al. Human cardiac tissue engineering: from pluripotent stem cells to heart repair. Curr Opin Chem Eng 2015 ; 7 : 57–64. [CrossRef] [PubMed] [Google Scholar]
- Bellamy V, Vanneaux V, Bel A, et al. Long-term functional benefits of human embryonic stem cell-derived cardiac progenitors embedded into a fibrin scaffold. J Heart Lung Transplant 2015 ; 34 : 1198–1207. [CrossRef] [PubMed] [Google Scholar]
- Segers VF, Lee RT. Biomaterials to enhance stem cell function in the heart. Circ Res 2011 ; 109 : 910–922. [CrossRef] [PubMed] [Google Scholar]
- Hirt MN, Hansen A, Eschenhagen T. Cardiac tissue engineering: state of the art. Circ Res 2014 ; 114 : 354–367. [CrossRef] [PubMed] [Google Scholar]
- Kupfer ME, Ogle BM. Advanced imaging approaches for regenerative medicine: emerging technologies for monitoring stem cell fate in vitro and in vivo. Biotechnol J 2015 ; 10 : 1515–1528. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Types cellulaires testés en clinique, mécanismes discutés, et effets recherchés. |
| Dans le texte | |
 |
Figure 2. Conditionnement moléculaire des cellules avant utilisation. |
| Dans le texte | |
 |
Figure 3. Productions cellulaires paracrines et effets sur l’homéostasie cardiaque. |
| Dans le texte | |
 |
Figure 4. Modalités de délivrance des cellules. |
| Dans le texte | |
 |
Figure 5. Mise en place sous-péricardique d’un biomatériau. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




