Figure 2.
Télécharger l'image originale
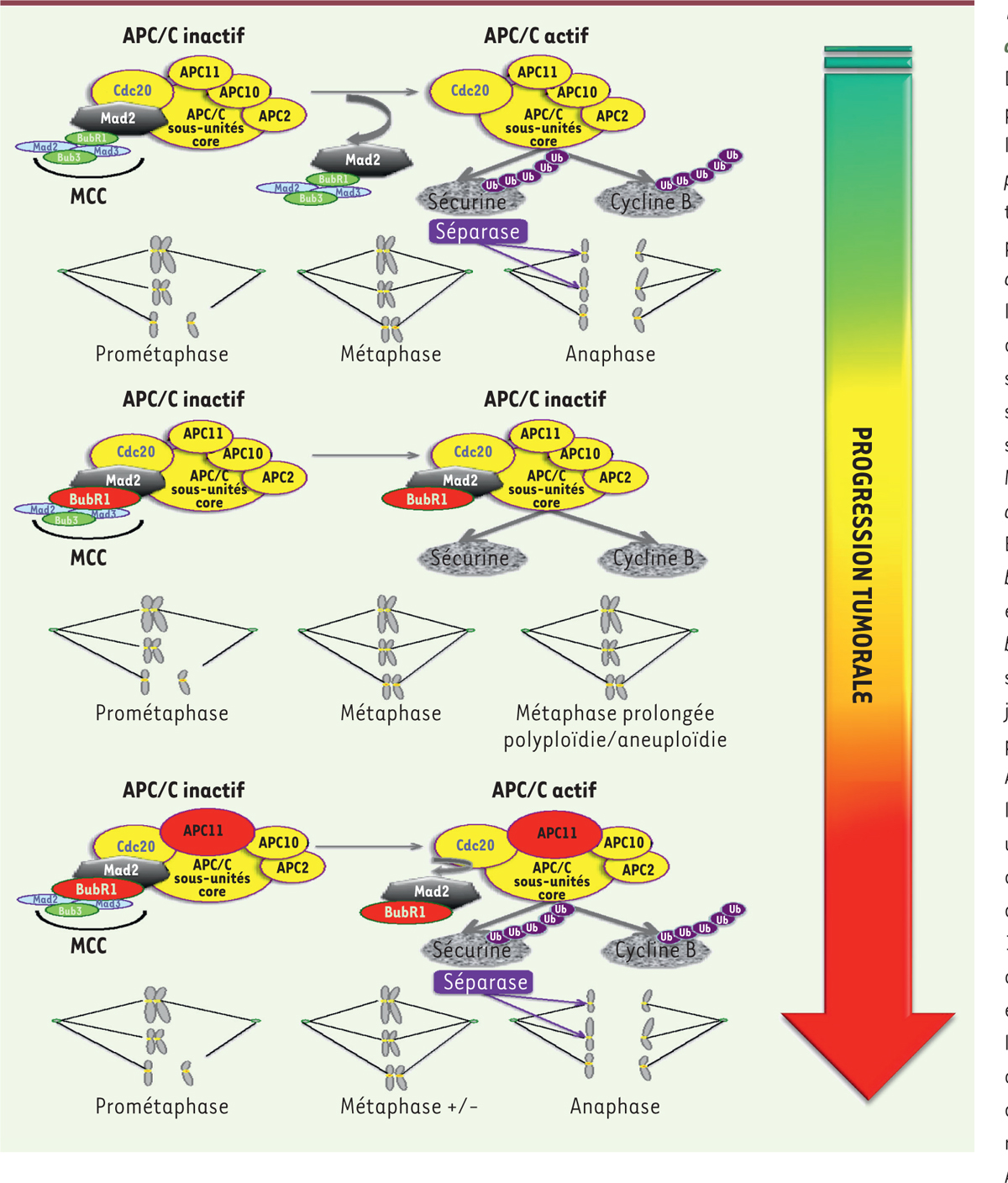
Facteurs contrôlant le déclenchement de l’anaphase. Dans les cellules normales, en prométaphase et en métaphase le complexe APC/C (anaphase promoting-complex) est maintenu dans un statut inactif par le complexe MCC (mItotic checkpoint complex) jusqu’à l’alignement et l’attachement de toutes les chromatides sœurs sur la plaque métaphasique. La sous-unité Cdc20 est séquestrée par le complexe MCC (Mad2 [mitotic arrest deficient 2], Mad1, Mad3/ BudR1 [budding uninhibited by benzimidazole-related 1], et Bub3 [budding uninhibited by benzimidazole 3]), inhibant sa capacité à activer l’APC/C, jusqu’à la transition métaphase-anaphase. Le complexe APC/C est alors activé par la libération de Cdc20, et va ainsi ubiquitinyler, via le complexe catalytique cœur (constitué des sous-unités APC2, 10 et 11), la sécurine qui sera dégradée par le protéasome et qui est associée à une protéase, la séparase. La séparase va alors cliver le complexe des cohésines, permettant la séparation des chromatides sœurs. APC/C ubiquitinyle également la cycline B pour permettre la sortie de mitose. Dans les premières étapes de la progression tumorale, une sur-activation du SAC (spindle-activated checkpoint) par surexpression d’un des facteurs du MCC, comme la kinase BubR1 retrouvée surexprimée dans des CRC, peut entraîner un arrêt prolongé en métaphase qui conduira la cellule vers une catastrophe mitotique et la mort, ou vers une endoreduplication, une polyploïdie et une instabilité de type CIN (chromosomal instability). Des variations dans la durée de la mitose peuvent potentiellement compromettre l’attachement et la séparation des chromatides sœurs. Un faible niveau de CIN est mieux toléré par les cellules et représente un moteur de la progression tumorale, tandis qu’un niveau élevé peut être délétère pour celles-ci. Afin de stabiliser ou d’atténuer l’accumulation de CIN, processus dynamique au cours de la progression tumorale, des altérations compensant une CIN excessive sont sélectionnées, comme la surexpression d’APC11. En exploitant la fonction suppresseur de tumeur d’une très forte instabilité CIN, l’utilisation d’un inhibiteur d’APC/C contribuerait à la cytotoxicité d’un poison du fuseau tel que le paclitaxel.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




