Figure 1.
Télécharger l'image originale
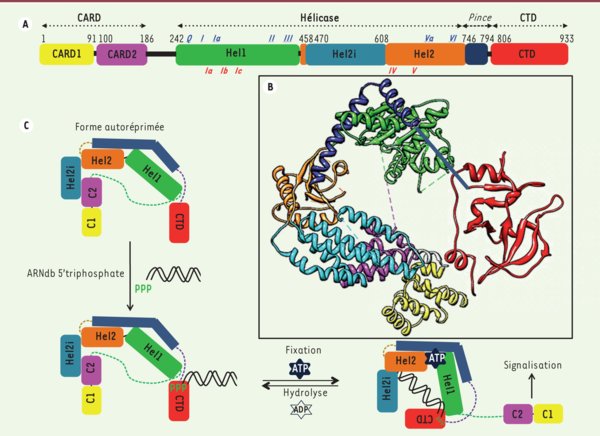
Structure et modèle de commutation du récepteur RIG-I. A. RIG-I est composé de deux domaines CARD (CARD1 en jaune et CARD2 en fuchsia), d’un domaine hélicase central qui comprend 3 sous-domaines (Hel1 en vert, Hel2 en orange et Hel2i, inséré dans Hel2, en bleu clair), et d’un domaine carboxy-terminal (CTD en rouge). Un domaine « pince » (en bleu foncé) relie les domaines Hel2 et CTD. Les motifs hélicase impliqués dans la liaison de l’ATP et de l’ARNdb sont indiqués (en italique souligné) respectivement en bleu (face supérieure) et en rouge (face inférieure). B. Structure cristallographique de la forme autoréprimée de RIG-I. Les domaines CARD, liés à l’hélicase au niveau du sous-domaine Hel1, interagissent avec le sous-domaine Hel2i via des interactions CARD2-Hel2i. Le domaine « pince », constitué de deux hélices α enveloppant le sous-domaine Hel1, établit une connexion mécanique entre Hel1, Hel2 et le CTD. L’emplacement de ce dernier domaine est modélisé car trop mobile dans le cristal pour être défini. Les structures sont issues de la banque de données des protéines (PDB) sous les références : 4A2Q pour le complexe CARD-hélicase et 4A2V pour le CTD. C. Modèle d’activation de RIG-I. RIG-I est présent dans le cytosol sous sa forme autoréprimée, les domaines CARD étant masqués par l’interaction entre les domaines Hel2i et CARD2. Lors d’une infection, le CTD, lié de façon flexible à l’hélicase, détecte l’extrémité 5’ triphosphate d’un ARNdb viral. Le rapprochement qui s’en suit permet à l’ARNdb d’entrer en compétition favorable avec le domaine CARD2 pour la liaison à l’hélicase. La double fixation d’ARN et d’ATP provoque un changement de conformation aboutissant au dévoilement des domaines CARD. Ces derniers recrutent alors le(s) partenaire(s) moléculaire(s) assurant la transmission du signal.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




