Figure 3
Télécharger l'image originale
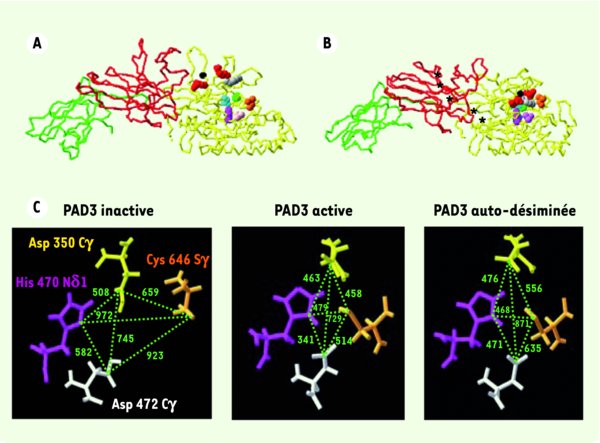
Modèles tridimensionnels de PAD3 et auto-désimination. A. Forme inactive, en absence de calcium. B. Forme active, en présence de calcium (*, cinq sites fixent le calcium). La liaison du calcium induit un changement structural important de l’enzyme qui entraîne son activation. En effet, en présence de calcium, les dix acides aminés majeurs du site actif se rapprochent les uns des autres pour structurer un site fonctionnel (Arg-346 et Arg-372 sont représentées en rouge, Trp-347 en gris, Asp-350 et Asp-472 en bleu, Gly-374 en noir, Val-468 en rose, His-470 en violet, Leu-640 en jaune et Cys-646 en vert). C. Grandissement au niveau des quatre acides aminés majeurs du site actif. En bas, à gauche : forme inactive, en absence de calcium (PAD3 [W8] Arg) ; en bas, au milieu : forme active, en présence de calcium (PAD3 [W9] Arg) sans auto-désimination ; en bas, à droite : forme auto-désiminée (PAD3 [W9] Cit 60-40). L’auto-désimination in silico a consisté à modifier en citrullines les arginines les plus accessibles (accessibilité aux solvants ≥ 40 %). Les distances calculées sont indiquées en picomètres. L’auto-désimination induit un élargissement du site actif de PAD3 en présence de calcium, l’augmentation des distances entre les quatre acides aminés Asp-350 (Cγ, jaune), Asp-472 (Cγ, blanc), His-470 (Nδ1, rose) et Cys-646 (Sγ, orange) pouvant atteindre 38 %.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




