Figure 1.
Télécharger l'image originale
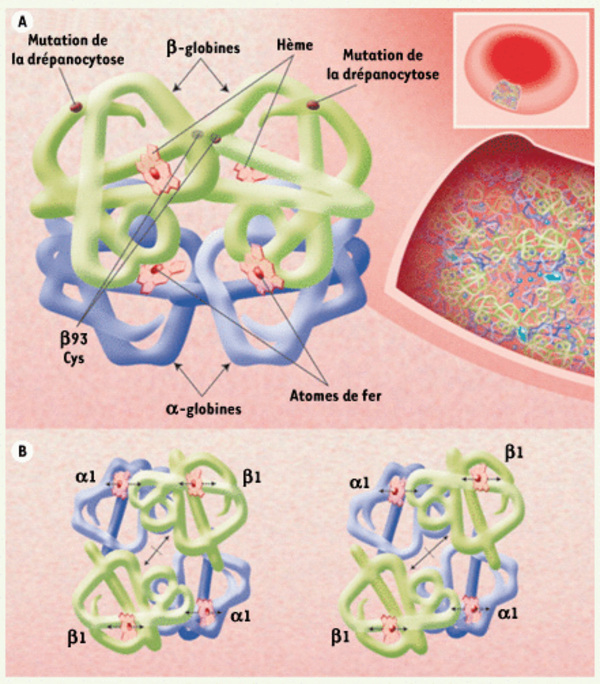
Structure de la molécule d’hémoglobine. A. Arrangement des hélices α (représentées comme des tubes) dans chacune des unités αβ, et localisation des 4 groupements hème avec leur atome de fer où se fixe la molécule de gaz. Ces 4 polypeptides du tétramère d’Hb délimitent un espace central dans lequel un groupement prosthétique de l’hème, la protoporphyrine IX, est fixée. Le site de la mutation caractérisant la drépanocytose est figuré sur le schéma, de même que la cystéine β93 très conservée. À droite, l’organisation très repliée des molécules d’Hb dans le globule rouge est illustrée ; une telle concentration (34g/dl) facilite le transport d’oxygène, mais explique la difficulté d’accès à cette molécule, et la facilité de polymérisation de l’Hb drépanocytaire lors d’une désoxygénation même minime. B. Représentation des changements de la structure quaternaire du tétramère d’Hb, vu du haut, lors de la transition de l’oxyHb (gauche) à la conformation désoxygénée (droite). L’atome de fer est déplacé, et une cavité se forme entre les chaînes β, favorisant la liaison du 2,3 DPG. Dessins originaux de Irving M. Geis, Illustration d’Alice Y. Chen (figure publiée dans Blood [19] - © Reproduite avec la permission de l’American Society of Hematology).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




