Figure 2.
Télécharger l'image originale
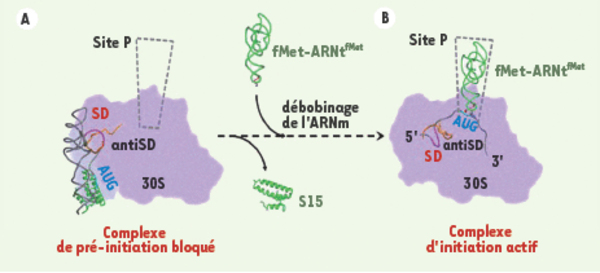
La structure repliée de l’ARNm peut piéger le ribosome dans un complexe de pré-initiation inactif. La fixation des ARNm structurés au niveau du ribosome implique une reconnaissance initiale (ancrage) suivi d’une accommodation du site de fixation de l’ARNm pour initier la traduction. A. La protéine ribosomique S15 stabilise une structure de l’ARNm en pseudo-nœud et empêche l’étape d’accommodation, piégeant le ribosome dans un complexe de pré-initiation inactif. L’étude de ce complexe de pré-initiation inactif par cryo-microscopie électronique et reconstruction 3D de particules isolées révèle que l’ARNm se trouve stabilisé dans un site bien défini à la surface de la petite sous-unité 30S [11]. Des analyses de séquences des ARN et protéines constituant ce site suggèrent que ce site est conservé à travers l’évolution. Il pourrait donc être utilisé par tout type de structure d’ARNm lors de la reconnaissance initiale par le ribosome. B. En l’absence de la protéine ribosomique S15, l’ARNm se déplie pour induire l’interaction avec l’ARNt initiateur dans le site P. Le mécanisme de « débobinage » de l’ARNm n’est pas encore bien compris et pourrait impliquer plusieurs composants de la machinerie du ribosome.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




