Figure 1.
Télécharger l'image originale
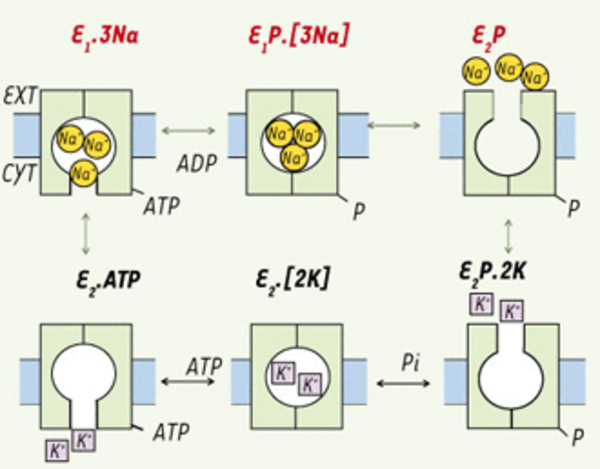
Le cycle de réaction de la Na,K-ATPase. Selon le modèle « Albers-Post » abrégé, l’enzyme en E1 lie le Na+CYT et l’ATP avec haute affinité. L’enzyme est alors phosphorylé sur un résidu aspartate dans la boucle cytoplasmique TM4-TM5 (voir Figure 2) menant à l’occlusion des ions de Na+ (E1P.[3Na]). Par suite d’un changement de conformation en E2P, l’affinité apparente pour le K+EXT est nettement augmentée et diminuée pour le Na+ tel que ces derniers sont relâchés en faveur de deux K+EXT (E2P.2K). Les ions de K+ sont alors occlus en E2P.[2K] qui est rapidement déphosphorylée pour donner E2.[2K]. Les ions de K+ sont à leur tour relâchés, l’enzyme lie l’ATP (liaison à basse affinité) pour former E2.ATP qui change rapidement de conformation de sorte que l’enzyme est prêt pour un autre cycle. Le cycle catalytique de cette pompe ionique de type P implique une translocation de Na+ et K+ couplée à une hydrolyse ATP impliquant une phosphorylation et une déphosphorylation de la sous-unité catalytique α (résidu aspartyl sur l’enzyme, E) et des transitions conformationnelles de la phospho -et déphosphoenzyme (E1P→E2P et E1→E2). Ext : extracellulaire ; Cyt : cytoplasmique.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




