Figure 2.
Télécharger l'image originale
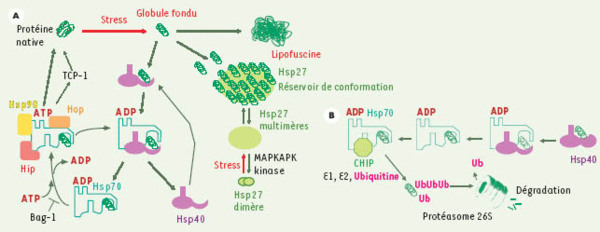
Machine moléculaire de repliement des protéines altérées et son couplage au système ubiquitine/protéasome. A. Repliement des protéines altérées au cours d’un stress. Les globules fondus formés au cours d’un stress présentent des zones hydrophobes à leur surface et sont alors reconnus par Hsp40 (équivalent procaryote : Hdj-1) qui, via son domaine J, forme un complexe avec la protéine de stress majeure Hsp70 (équivalent procaryote : DnaK). Celle-ci, sous sa forme liant l’ADP, englobe alors la protéine dénaturée dans son domaine peptidique. La renaturation de la protéine substrat par Hsp70 nécessite la participation de polypeptides cochaperons tels que Hip, Hop et Hsp90. Une activation de la machinerie de repliement via le remplacement de l’ADP associé à Hsp70 par l’ATP est nécessaire pour relâcher la protéine substrat. Bag-1 est un cochaperon déstabilisant la forme ATP du complexe Hsc70/Hsp70-substrat. Enfin, certains polypeptides nécessitent une étape ultérieure de repliement par la protéine eucaryote TCP-1 ring complex (également dénommée TRiC, ou CCT). Celle-ci appartient à un groupe de protéines chaperons ayant une structure commune, les chaperonines : par exemple, Hsp60/Hsp10 (dont l’analogue procaryote est GroEL/GroES) est un analogue de TCP-1 retrouvé dans la mitochondrie (voir Figure 4). Dans des conditions où le système est saturé par un afflux massif de protéines à replier, un stockage transitoire des globules fondus est effectué par des structures oligomériques formées par les Hsp de bas poids moléculaire (type Hsp27) : ces réservoirs d’intermédiaires de repliement dirigeraient ensuite les protéines substrats vers les différentes étapes de la machinerie de repliement. Les Hsp de bas poids moléculaires sont également caractérisées par leur très grande résistance à la dénaturation, afin de rester le plus possible efficace au cours d’un stress. MAPKAPK2 : mitogen-activated protein kinase-activated protein kinase 2. B. Couplage du repliement et de la voie de dégradation des protéines ubiquitine-protéasome. Dans certaines conditions, les atteintes conformationnelles des protéines sont très graves et la cellule peut décider, via la protéine CHIP (carboxy terminus of Hsc70 interacting protein), de diriger les protéines difficiles à replier vers un couplage à l’ubiquitine et une dégradation par le protéasome 26S. Dans le cas des protéines irréversiblement oxydées (qui forment aussi des structures de type globule fondu), la dégradation se ferait plutôt via le protéasome 20S sans couplage préalable à l’ubiquitine. En effet, le protéasome 20S semble être plus résistant que son homologue 26S à une dénaturation fonctionnelle induite par une oxydation.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




