Figure 2.
Télécharger l'image originale
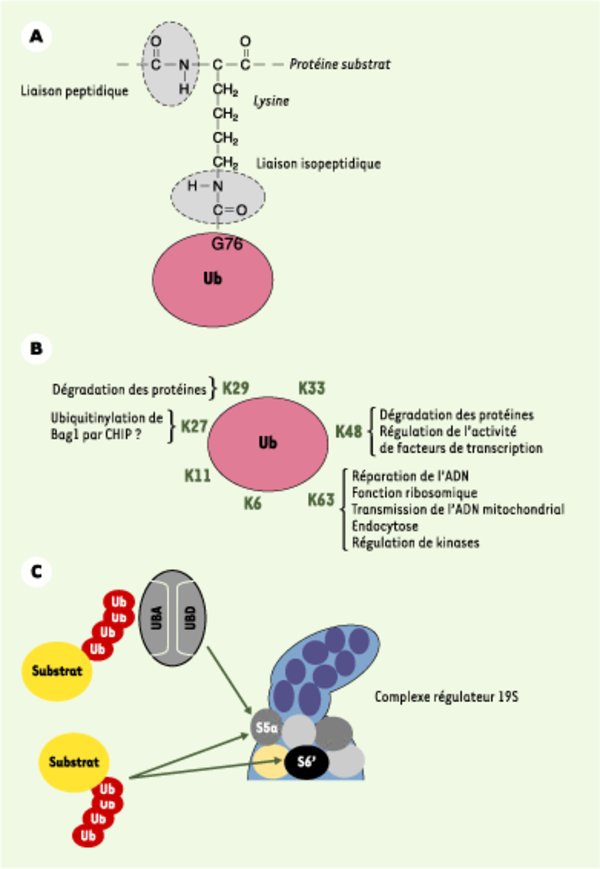
Les différentes chaînes d’ubiquitine. A. La liaison isopeptidique. L’ubiquitine est conjuguée sur ses substrats via une liaison isopeptique entre son extrémité carboxyterminale et le groupement ε-NH2 des lysines acceptrices de ces derniers. Il s’agit d’une liaison amide, comme la liaison peptidique qui relie les acides aminés d’une même protéine entre eux. Dans certains cas, rares jusqu’à présent, l’ubiquitine peut se conjuger via une liaison peptidique classique entre son extrémité carboxyterminale et le NH2 terminal de la protéine acceptrice. B. Les chaînes d’ubiquitine. Les 7 lysines permettent la conjugaison de l’ubiquitine sur elle-même in vivo. Le rôle biologique des différentes chaînes n’est pas encore établi. Les chaînes K48 sont les plus mises en évidence, car elles servent à la dégradation des protéines. Elles sont toutefois également impliquées dans la régulation de l’activité de facteurs de transcription. L’existence de chaînes comportant des liaisons mixtes reste à caractériser. La longueur des chaînes est probablement un paramètre important pour leur action. Par exemple, des dimères d’ubiquitine couplés via la lysine 63 règlent l’endocytose de certains récepteurs membranaires, tandis que des chaînes plus longues modulent des activités kinases. C. Reconnaissance des substrats ubiquitinylés par le protéasome. Les substrats ubiquitinylés peuvent interagir directement ou indirectement avec le protéasome. Les chaînes d’ubiquitine peuvent ainsi reconnaître les sous-unités S5a et S6’ du complexe régulateur 19S. S6’ est l’une des ATPases de l’anneau de chaperons au contact du 20S. S5a occupe, quant à elle, une position intermédiaire entre la base et le couvercle du 19S. Cette protéine est reconnnue par les protéines navettes à UBD (domaine ubiquitin-like) et UBA (domaine se liant à l’ubiquitine) comme Rad23. L’ensemble des interactions des protéines à domaines UBD et UBA avec le protéasome 26S doit encore être précisé. CHIP : carboxy terminus of Hsp70-interacting protein ; Bag1 : Bcl2-associated athanogene.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




