Figure 2.
Télécharger l'image originale
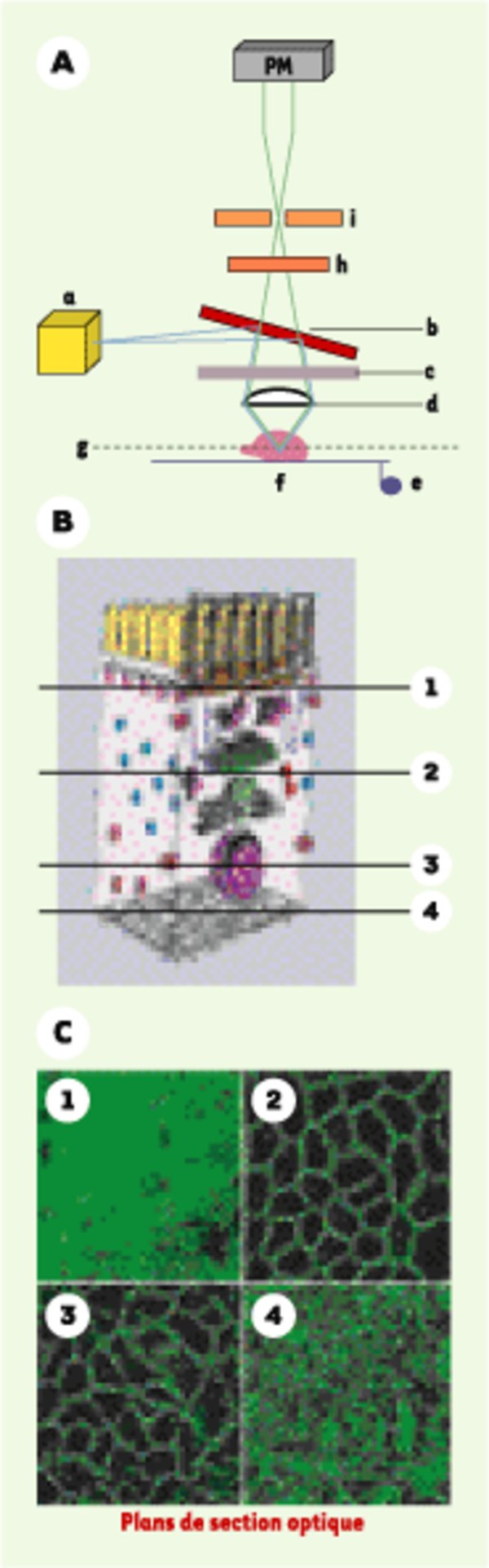
La microscopie confocale classique, outil d’exploration tridimensionnelle des cellules et des tissus. A. Principe de base d’un microscope confocal. Une source de lumière cohérente (laser, a) délivre un faisceau de lumière cohérente (tracé bleu). Ce faisceau est réfléchi par un miroir dichroïque (b) qui illumine l’échantillon biologique à analyser (f) au travers de l’objectif du microscope (d). Un dispositif de balayage (c) permet de déplacer le faisceau sur la totalité de l’échantillon. Un moteur de haute précision (e), dont le pas est de 25 à 40 nm, permet de déplacer la platine du microscope par rapport à l’objectif dans l’axe xz pour obtenir une succession de coupes sur des plans focaux successifs (g) dans la profondeur de l’objet. Les fluorochromes présents dans l’objet biologique excités par le faisceau lumineux vont réémettre des photons de longueur d’onde supérieure (tracé vert) qui traverseront le miroir dichroïque puis un filtre d’émission ou un prisme (h) calibrant la longueur d’onde émise. Un dispositif de diaphragme ou pinhole (i) ne laisse passer que les photons provenant spécifiquement du plan focal analysé et les envoie sur un photomultiplicateur (PM). B. Les images recueillies par le dispositif confocal correspondent à des plans optiques définis. Dans l’exemple choisi, le plan 1 est situé sous la bordure en brosse d’une cellule épithéliale, le plan 2 est supranucléaire, le plan 3 traverse le noyau et le plan 4 est placé au niveau de la base cellulaire. C. Échantillon de cellules intestinales en culture (Caco-2) analysé par immunofluorescence utilisant de la phalloïdine fluorescente (marqueur de l’actine polymérisée) et microscopie confocale. Les quatre plans présentés correspondent aux plans du panneau B. On note les formes d’organisation très différentes de l’actine selon le plan considéré : réseau sous-cortical correspondant à la base de la bordure en brosse (en 1), réseau sous-membranaire organisé en paquets correspondant au cytosquelette de la membrane latérale (en 2 et 3) et organisation en fibres de stress correspondant à la zone d’interaction cellule-matrice (en 4).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




