Figure 2.
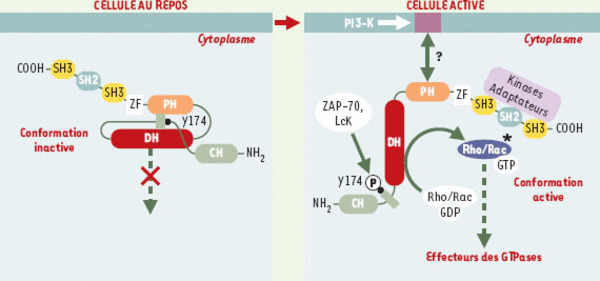
Régulation de l’activité des protéines Vav. Dans la cellule au repos, Vav1 se trouve dans une conformation inactive dans laquelle la queue amino-terminale se replie entre les domaines DH et PH masquant ainsi l’activité d’échange GDP/GTP et bloquant la phosphorylation de la tyrosine 174 (Y174). Dans la cellule activée, Vav1 se lie via son domaine PH aux phospholipides membranaires phosphorylés par la PI3-K (phosphatidylinositol-3 kinase) et se déplie dans sa conformation active. La phosphorylation de Vav1 sur sa tyrosine 174 entraîne l’augmentation de l’activité enzymatique de son domaine DH (Dbl homology) et favorise l’échange de GDP en GTP sur les petites GTPases de la famille Rho/Rac, qui participent à l’activation cellulaire par l’intermédiaire de leurs effecteurs. Notons que la région adaptatrice comprenant les domaines SH3-SH2-SH3 peut modifier l’activité des protéines Vav en recrutant des protéines de signalisation.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




