Figure 1.
Télécharger l'image originale
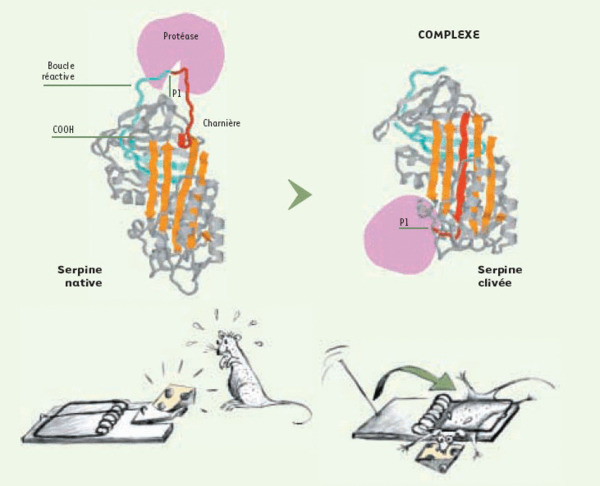
Le mécanisme inhibiteur des serpines. Les serpines possèdent toutes la même structure tridimensionnelle : un cœur de 2 feuillets ß dont un dit “ principal ” (en orange) entouré de 9 hélices α, et une boucle réactive exposée à la surface, qui se présente comme un véritable appât pour la protéase cible. Celle-ci coupe la boucle réactive en aval d’un résidu précis, dénommé P1 par convention, qui confère sa spécificité à l’interaction serpine/protéase. Grâce à l’instabilité thermodynamique de cette forme native et à la grande flexibilité de sa boucle, il s’ensuit un brusque mouvement de bascule qui conduit à l’insertion de la partie amino-terminale de celle-ci dans le feuillet ß principal, qui acquiert ainsi un sixième brin (rouge). La protéase, qui bascule de 180 degrés, se retrouve alors piégée à l’autre extrémité de la serpine dans un complexe covalent particulièrement stable. Cette brutale délocalisation induisant une distortion de son site actif est à la base du processus inhibiteur. Le peptide carboxyterminal (bleu) engendré par la coupure reste inséré dans la serpine.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




