| Numéro |
Med Sci (Paris)
Volume 40, Numéro 10, Octobre 2024
|
|
|---|---|---|
| Page(s) | 729 - 736 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024115 | |
| Publié en ligne | 25 octobre 2024 | |
Récepteurs des œstrogènes et vieillissement artériel
Estrogen receptors and vascular aging
1
Inserm U1297, Institut des maladies métaboliques et cardiovasculaires (I2MC), Université de Toulouse 3 Toulouse France
2
Université d’Angers, département MITOVASC, équipe CarMe, Inserm U1083, CNRS UMR 6015 Angers France
Les maladies cardiovasculaires (MCV) sont souvent perçues comme étant principalement masculines, alors qu’elles représentent la première cause de mortalité chez les femmes. Bien que les effets bénéfiques des œstrogènes soient bien établis chez les organismes jeunes, la question de savoir si les œstrogènes exogènes peuvent prolonger la protection contre les MCV après le début de la ménopause n’est toujours pas résolue. Cette revue décrit les études sur les effets des œstrogènes sur les artères, en mettant l’accent sur l’impact du vieillissement sur l’endothélium. Nous aborderons également l’impact de l’âge sur l’expression et la signalisation des récepteurs des œstrogènes (ER), avant d’exposer le progrès des connaissances sur les mécanismes d’action d’ERα afin d’optimiser le traitement hormonal de la ménopause.
Abstract
After years of studying cardiovascular diseases (CVD) in men due to their higher incidence compared to women, attention is now being paid to female CVD and their pathophysiology. Even though premenopausal women have a lower incidence of CVD, this disparity progressively diminishes after menopause, highlighting the key role of sex hormones. Many preclinical and fundamental studies have demonstrated protective effects of estrogens on arterial endothelium, suggesting that hormone therapy could improve cardiovascular health in menopausal women. However, disappointing outcomes from a major clinical trial two decades ago questioned the cardiovascular protection by estrogens with age. In this review, we will summarize the main clinical and experimental studies reporting the effects of estrogens on CVD, with a focus on their impact on endothelial function. Then, we will present abnormalities in the expression and signaling of estrogen receptors (ERs) in the arteries, and the contribution of conventional estrogens to arterial protection during aging. Finally, we will examine how recent advances in the mechanisms of action of ERa could help to optimize hormone therapy for menopause.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© National Center for Biotechnology Information, National Library of Medecine).
Alors qu’elles représentent la première cause de mortalité chez les femmes, les maladies cardiovasculaires (MCV) sont largement sous estimées et insuffisamment prises en charge car longtemps considérées comme un problème essentiellement masculin. En effet, les femmes en période d’activité génitale sont globalement protégées vis-à vis du risque cardiovasculaire, par rapport aux hommes, comme l’a rapporté, il y a plus de 70 ans, l’étude épidémiologique de Framingham1 [1]. Cette protection est attribuée aux œstrogènes et plus particulièrement à l’action du 17-β œstradiol (ou E2), l’œstrogène majoritaire produit par les ovaires en période d’activité génitale chez la femme. La ménopause, caractérisée par l’arrêt de la fonction ovarienne et une chute de production d’E2, expose les femmes à un risque accru de MCV [2]. Plus la survenue de la ménopause est précoce, plus le risque augmente [3]. Sur la base de ces données cliniques, l’action des œstrogènes a fait l’objet de nombreuses recherches expérimentales qui ont permis de démontrer une action bénéfique de ces hormones directement sur les artères [4], mais aussi dans la régulation de la réponse immuno-inflammatoire [5] et des fonctions métaboliques [6], deux composantes majeures liées au risque de MCV (Figure 1).
 |
Figure 1. Effets non exhaustifs des œstrogènes dans la prévention du risque cardiovasculaire. Alors que les effets bénéfiques des œstrogènes endogènes sont bien établis chez la femme jeune, une question clé reste en suspens : dans quelle mesure ces effets peuvent être préservés à la ménopause par un apport d’œstrogènes exogènes dans le cadre du traitement hormonal de la ménopause (THM) ? |
Au début des années 1990, les résultats de la Nurse Health Study, dite « Étude des infirmières de Boston », rapportent une diminution des accidents cardiovasculaires chez les femmes ménopausées prenant un traitement hormonal de la ménopause (THM), suggérant un effet bénéfique des œstrogènes [7]. Mais ces bénéfices ont été remis en question à la suite de la publication de l’étude américaine Women’s Health Initiative (WHI) qui a rapporté, en 2002, contre toute attente, un risque accru de pathologies cardiovasculaires (infarctus, accident vasculaire cérébral, thrombose veineuse), associé au THM sous forme de composés conjugués équins (CEE) traditionnellement utilisés aux États-Unis [8]. Cependant, cette étude avait été conduite chez des femmes dont la plupart avaient été traitées plus de 10 ans après le début de leur ménopause et de nouvelles analyses de l’essai clinique soulignèrent l’importance du moment d’initiation du traitement [9]. En effet, l’apport d’œstrogènes exogènes, de type CEE, confère une protection vis-à vis du risque cardiovasculaire s’il est initié au début de la ménopause, chez les femmes les plus jeunes (âgées de 50 à 59 ans), mais il a un effet néfaste s’il est commencé tardivement, à distance de la ménopause après l’âge de 60 ans. L’hypothèse de l’importance de ce timing a été confirmée en 2016 par les résultats de l’étude Early versus Late Intervention Trial with Estradiol (ELITE). Cette étude fondée sur l’utilisation d’un traitement par l’œstradiol (E2), l’hormone naturelle utilisée en Europe, a en effet montré des effets bénéfiques sur le développement de l’athérosclérose carotidienne chez les femmes ménopausées recevant le traitement jusque 6 ans après l’apparition de la ménopause, par rapport à celles recevant le traitement plus tardivement (plus de 10 ans après la ménopause) [10]. L’une des principales questions est de savoir jusqu’à quand les effets bénéfiques/protecteurs des œstrogènes restent efficaces avec l’avancée de l’âge (Figure 2).
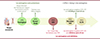 |
Figure 2. Évolution de la compréhension de l’impact des œstrogènes sur l’incidence des maladies cardiovasculaires à travers les études cliniques. Initialement, les traitements hormonaux de la ménopause (THM) étaient largement prescrits en raison de leur capacité à soulager les symptômes et à prévenir les maladies chroniques associées au vieillissement, y compris les maladies cardiovasculaires (MCV). Alors que les effets bénéfiques des œstrogènes sur les MCV sont bien établis dans les organismes jeunes, la question de savoir si un apport d’œstrogènes exogènes protège du risque accru de MCV associé à la ménopause n’est toujours pas résolue. Ce point fait débat depuis les conclusions du grand essai clinique de la Women’s Health Initiative (WHI), révélant une augmentation des MCV chez les femmes sous traitement hormonal de la ménopause. Les nouvelles analyses de cette étude nuancent toutefois cette conclusion, en rapportant un effet « timing » avec une protection du risque coronarien par les œstrogènes exogènes chez les femmes traitées avant 60 ans mais un impact délétère de ces hormones chez les femmes ayant reçu ce traitement plus tardivement. |
Dans cette revue, nous décrirons les principales études expérimentales rapportant les effets des œstrogènes exogènes, sur la paroi artérielle, avec un focus particulier sur l’endothélium artériel, une cible majeure dans l’action bénéfique de ces hormones ; des études en parfait accord avec la protection artérielle conférée par les œstrogènes endogènes chez les femmes avant la ménopause. Nous envisagerons ensuite dans quelle mesure, des anomalies dans l’expression et/ou la signalisation des récepteurs des œstrogènes (ER) pourraient expliquer la perte, avec l’âge, de la protection artérielle conférée par les œstrogènes. Enfin, nous verrons si les progrès récents de la compréhension des mécanismes d’action de l’ERα dans les artères peuvent contribuer à l’optimisation de la thérapie hormonale.
Les effets bénéfiques des œstrogènes sur la paroi artérielle dans les modèles expérimentaux
Modélisation expérimentale de la ménopause
La ménopause, du grec mêniaia, « menstrues », et pausis, « fin », est cliniquement caractérisée par l’arrêt définitif des menstruations et de l’activité folliculaire ovarienne se traduisant par une chute de la production d’E2. Il est important de noter que la ménopause n’a été observée jusqu’à présent que chez les êtres humains, et seulement chez quatre autres espèces à l’état sauvage : les bélugas, les narvals, les orques, les globicéphales à bec court [11]. Les autres espèces de mammifères, notamment les rongeurs, classiquement utilisés comme modèles expérimentaux dans les laboratoires, connaissent un déclin du pool folliculaire ovarien avec l’âge (oopause), sans diminution de la production d’E2. En recherche préclinique, l’ovariectomie (ablation des deux ovaires) constitue un modèle expérimental de « ménopause chirurgicale » permettant d’étudier les conséquences du déclin des hormones sexuelles [12].
L’effet vasodilatateur des œstrogènes
La production d’oxyde nitrique (NO) par les cellules endothéliales est cruciale dans les vaisseaux sanguins. Il agit comme un vasodilatateur et prévient l’adhérence plaquettaire, contribuant ainsi à la régulation du flux sanguin et à l’intégrité vasculaire. In vivo, dans des modèles expérimentaux de lapin, la production basale de NO est plus importante chez la femelle que chez le mâle et est abolie par ovariectomie [13]. Ex vivo, l’E2 améliore la dilatation dépendante de l’endothélium dans différentes artères [14]. Cependant, cet effet bénéfique de l’E2 sur la vasorelaxation diminue avec l’âge, avec une réponse à un apport exogène d’E2 moins prononcée, comme on peut l’observer chez des rates hypertendues âgées de 8 mois, par rapport à des rates hypertendues âgées de 3 mois [15]. Chez la souris, une diminution de la vasodilatation en réponse à un apport exogène d’E2 dans les artères utérines de souris âgées de 29 mois, comparées à des souris jeunes, a également été rapportée. Cette perte d’effet bénéfique de l’E2 est associée à une réduction de la relaxation dépendante de l’endothélium à l’état basal et à une augmentation de la rigidité artérielle, deux caractéristiques du vieillissement vasculaire [16]. Le vieillissement, per se, diminue en effet la relaxation dépendante de l’endothélium dans l’aorte et l’artère mésentérique (diminution de 20 % chez les souris femelles âgées de 18 mois par rapport aux jeunes souris femelles) [17].
Les effets athéroprotecteurs des œstrogènes
L’athérosclérose est une maladie évolutive caractérisée par l’accumulation de cholestérol dans l’intima2 des artères. Des études menées sur des singes, des lapins et des souris hypercholestérolémiques ont permis de montrer l’effet préventif que l’E2 exerce sur l’athérosclérose [18–20]. Cependant, la plupart de ces analyses ont été réalisées sur des animaux adultes jeunes (Tableau I). Seules quelques études expérimentales ont exploré l’impact du vieillissement ou de la durée de la privation d’œstrogènes sur l’athérosclérose. Les travaux pionniers réalisés par le groupe de Clarkson sur des singes ont montré que l’administration d’œstrogènes ralentit efficacement la progression de l’athérosclérose coronarienne, uniquement lorsqu’elle est initiée peu de temps après l’ovariectomie [21, 22], suggérant que l’E2 prévient l’initiation de l’athérosclérose dans les artères saines, mais qu’il est inefficace si la maladie est déjà établie. Des observations similaires ont été rapportées dans les souris modèle d’athérosclérose, les souris ApoE-/- dépourvues du gène codant l’apolipoprotéine E, âgées de 20 semaines, chez lesquelles l’effet athéroprotecteur de l’E2 est perdu lorsqu’il était initié après 45 jours de privation œstrogénique [23].
Principales études expérimentales rapportant l’effet de l’âge ou du statut oestrogénique sur les effets vasculaires chez la femelle. ND : non déterminé ; Ovx : ovariectomisée ; E2 : 17β-estradiol ; CEE : conjugated equine estrogens.
Les œstrogènes et la cicatrisation endothéliale
La cicatrisation endothéliale désigne la capacité de l’endothélium à se régénérer après une blessure. Le maintien de l’intégrité de la barrière endothéliale est essentiel pour préserver l’homéostasie entre la circulation sanguine et les tissus environnants. L’endothélium joue un rôle crucial en tant que membrane semi-perméable, empêchant diverses pathologies vasculaires, telles que l’athérosclérose, la resténose (cicatrisation excessive), et la formation de thrombus. La capacité de régénération de l’endothélium est donc essentielle. Initialement, l’effet accélérateur de l’E2 sur la cicatrisation endothéliale a été observé chez des rates ovariectomisées, suite à une dénudation de l’artère carotide par ballonnet [24]. Notre équipe a confirmé cet effet bénéfique de l’E2 sur la réendothélialisation, après une lésion électrique ou mécanique de l’artère carotide, chez la souris ovariectomisée jeune [25, 26]. Un effet délétère du vieillissement sur le processus de cicatrisation endothéliale a par ailleurs été rapporté chez les lapins mâles âgés de 4 ans, avec une réendothélialisation diminuée de 40 % par rapport à celle observée chez les lapins jeunes âgés de 7 mois [27]. L’impact spécifique du vieillissement et/ou de la durée de la privation d’œstrogènes sur la cicatrisation endothéliale en réponse aux œstrogènes reste cependant à déterminer.
Dans l’ensemble, les résultats des études expérimentales démontrent que la durée de la privation en œstrogènes, la progression des maladies vasculaires ainsi que le vieillissement artériel per se peuvent avoir un impact négatif sur les actions bénéfiques de l’E2, potentiellement responsable de l’effet « timing » rapporté dans par les résultats des essais cliniques. Mais dans quelle mesure un défaut d’expression ou de signalisation des ER pourraient expliquer cette diminution de l’action œstrogénique liée au vieillissement ?
Évolution de l’expression/signalisation des récepteurs des œstrogènes au cours du vieillissement
ERα, le récepteur clé dans l’action vasculaire des œstrogènes
Les œstrogènes exercent leurs effets en se liant aux récepteurs des œstrogènes dont trois ont, actuellement, été identifiés : ER alpha (ERa) et ER beta (ERβ), qui appartiennent à la superfamille des récepteurs nucléaires3 [28], et le récepteur d’œstrogènes couplé aux protéines G (GPER1, pour G proteincoupled estrogen receptor 1), identifié plus récemment [29]. ERa est le récepteur majoritaire. En effet, différentes études à large échelle montrent qu’il est le seul récepteur d’œstrogènes détecté dans les artères de souris [30]. Les résultats obtenus avec des souris invalidées spécifiquement pour ERa ont par ailleurs démontré son rôle crucial pour relayer les effets bénéfiques vasculaires de l’E2 [31,32]. Le rôle d’ERα dans les différents composants cellulaires de la paroi artérielle a été étudié grâce au système Cre/Lox, avec une invalidation spécifique, soit dans les cellules endothéliales (contrôlée par le promoteur de Tie2 [angiopoietin-1 receptor]), soit dans les cellules musculaires lisses (CML) (contrôlée par le promoteur du gène codant l’αSMA [alpha smooth muscle actin]). Ces approches ont montré le rôle majeur d’ERα dans les cellules endothéliales, comme en témoigne la perte des effets bénéfiques de l’E2 chez les souris femelles Tie2Cre+ ERαlox/lox, notamment dans la protection contre l’athérome, la production de NO et l’accélération de la cicatrisation endothéliale [33,34]. Le rôle d’ERα des CML dans l’action préventive de l’E2 sur l’hyperplasie de la néointima, après agression de l’artère fémorale de la souris, a été démontré en utilisant le modèle de souris αSMACreERT2ERαlox/lox [35].
L’identification de GPER1 a complexifié les voies de signalisation des récepteurs des œstrogènes déjà connus. Contrairement aux ER, récepteurs nucléaires des œstrogènes classiques, GPER1 n’appartient pas à la famille des récepteurs nucléaires, et est présent à la membrane plasmique : sa signalisation, après fixation à son ligand, repose sur l’activation de différents seconds messagers. Si le rôle de GPER1 dans la fertilité des poissons a été clairement démontré, ce n’est pas le cas chez les mammifères. En effet, les modèles murins d’inactivation génique de GPER1, qui ont été générés indépendamment par quatre équipes différentes, présentent des phénotypes différents [36], mais ils sont tous fertiles. GPER1 a néanmoins été impliqué dans certains effets vasculaires bénéfiques des œstrogènes, tels que la protection contre l’athérosclérose et l’hypertension. Le développement d’agonistes (G1) et d’antagonistes (G15 et G16) sélectifs de GPER ont permis d’approfondir nos connaissances sur les effets biologiques de ce récepteur. L’utilisation de G1, in vivo, a ainsi permis de montrer que l’activation de GPER induit une vasodilatation dépendante de l’endothélium, et améliore l’hypertension expérimentale [37]. Dans la plupart de ces expériences, la concentration de G1 utilisée était de 3 µM, tout comme celle de l’E2, c’est-à-dire 4 à 5 plus élevée que le niveaux physiologique d’E2, questionnant la spécificité et la pertinence de ces observations. En tout état de cause, l’ensemble des travaux concernant les récepteurs des œstrogènes démontrent le rôle clé d’ERα dans l’effet direct des œstrogènes sur les cellules de la paroi artérielle.
Évolution de l’expression d’ERα avec l’âge
La diminution de l’expression d’ERα avec l’âge pourrait représenter un déterminant majeur dans la perte des effets bénéfiques des œstrogènes sur les vaisseaux lors du vieillissement. Une diminution importante de l’expression d’ERα et une légère augmentation de l’expression d’ERβ ont été observées dans l’endothélium et le muscle lisse de souris femelles SAMP (senescence-accelerated mouse prone), des souris prédisposées à une sénescence accélérée, ovariectomisées [38]. Bien que non significative, une légère réduction des niveaux protéiques d’ERα et d’ERβ est observée dans l’aorte de rates vieillissantes (âgées de 16 mois) par rapport aux rates plus jeunes (âgés de 12 mois) [28]. Dans l’espèce humaine, une autre étude a montré que l’expression d’ERα est réduite dans les plaques d’athérosclérose des artères des femmes post-ménopausées, comparée celle déterminée chez des femmes pré-ménopausées [39]. La diminution de l’expression d’ERα pourrait être, au moins en partie, due à la méthylation des îlots cytosine-phosphate-guanine (CpG)4 présents dans la région promotrice du gène, comme cela a été rapporté dans une étude portant sur une cohorte de 130 femmes en bonne santé, âgées de 40 à 73 ans [40, 41]. Cependant, les informations concernant les modifications touchant les ER dans les vaisseaux vieillissants restent limitées et certaines études suggèrent que la privation d’œstrogènes, plus que l’âge lui-même, influencerait l’expression d’ERα [42, 43].
Évolution de la signalisation cytoplasmique d’ERα avec l’âge
Au-delà de l’expression des récepteurs, la ou les différentes voies de signalisation oestrogénique pourraient être altérées au cours du vieillissement artériel. ERa appartenant à la superfamille des récepteurs nucléaires, il fonctionne classiquement comme un facteur de transcription, mais il exerce également des actions extranucléaires et non génomiques, par l’activation du signal stéroïdien initié rapidement à la membrane (en anglais, membrane initiated steroid signaling, MISS), une signalisation induite directement après liaison d’E2 à l’ERa situé à la membrane plasmique (Figure 3). En combinant des modèles de souris génétiquement modifiées avec des outils pharmacologiques spécifiques, notre équipe a largement contribué à démontrer l’importance de la signalisation membranaire d’ERα stimulée par l’E2, dans la production endothéliale de NO et la cicatrisation endothéliale [28]. Ces effets bénéfiques sont perdus dans le modèle de souris ERaC451A dépourvues d’ERα membranaire, car exprimant un récepteur muté au niveau du site de palmitoylation de la protéine qui permet son adressage membranaire. En revanche, les effets bénéfiques de l’E2 sont préservés dans un modèle murin de perte de fonction de l’ERa nucléaire (souris ERaAF20) [44]. Étant donné que la relaxation de l’endothélium en réponse à l’E2 est diminuée dans les modèles d’animaux âgés [16, 17], il serait intéressant de savoir si la localisation subcellulaire de l’ERa est altérée avec l’âge, et de comprendre comment les signalisations de l’ERa membranaire et de l’ERa nucléaire sont respectivement affectées par le processus de vieillissement.
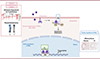 |
Figure 3. Mécanisme d’action du récepteur des œstrogènes (ERα). Action nucléaire d’ERα : la fixation du 17-β œstradiol (E2) à ERα présent dans le cytoplasme déclenche des changements conformationnels du récepteur qui conduisent à sa translocation nucléaire et à sa fixation sur des séquence d’ADN spécifiques. Une fois fixé au promoteur de ses gènes cibles, ERα. initie leur transcription en recrutant des coactivateurs. Action membranaire de ERα : après palmitoylation, ERα peut également se localiser à la membrane plasmique et initier une cascade de signalisation stéroïdienne rapide initiée par la membrane (ERαMISS) en interagissant avec différentes protéines, telles que Gαi, Src, PI3K (phosphoinositide 3-kinase) et eNOS (NO synthase endothéliale). La dilatation de l’endothélium et la ré-endothélialisation dépendent de l’action membranaire d’ERα, tandis que la prévention de l’athérosclérose dépend de l’action nucléaire d’ERα. |
Conclusion et perspectives
Après des années de recherches principalement axées sur le risque cardiovasculaire associé au vieillissement chez les hommes, on observe un intérêt croissant concernant l’évaluation des différences liées au sexe, en particulier dans la physiopathologie cardiovasculaire chez les femmes, notamment après la ménopause. Cette période de la vie de la femme, qui est associée à un risque accru de MCV, soulève des interrogations importantes quant aux rôles respectifs de l’âge et de la déficience hormonale dans le risque cardiovasculaire. L’impact du traitement hormonal de la ménopause sur l’incidence des MCV est d’ailleurs sujet à débat depuis plusieurs décennies.
Les différentes études cliniques et expérimentales permettent de conclure que les œstrogènes endogènes apportent une protection artérielle chez la femme en période d’activité génitale, et que l’apport des œstrogènes exogènes classiques après la ménopause n’a qu’un effet limité vis-à-vis du risque cardiovasculaire. Cette perte d’action bénéfique des œstrogènes pourrait s’expliquer par une diminution de l’expression et/ou de la signalisation d’ERα, le principal récepteur relayant l’action bénéfique des œstrogènes dans les artères.
Les œstrogènes naturels de la grossesse, l’estriol (E3) et surtout l’estétrol (E4), produits respectivement par le placenta et le foie fœtal, représentent des options intéressantes à considérer en médecine. En particulier, l’E4 a récemment été approuvé par la Food and Drug Administration (FDA) aux États-Unis, et par l’Agence européenne des médicaments (EMA) pour la contraception orale, et fait l’objet d’un essai clinique de phase III pour le traitement hormonal de la ménopause. L’E4, prescrit par voie orale, induit peu, voire pas, d’effets sur les facteurs de coagulation dérivés du foie, comparé aux œstrogènes oraux classiques, et pourrait ainsi ne pas augmenter le risque thromboembolique veineux. Dans des modèles murins de lésions endothéliales, alors que l’E2 et l’E3 accélèrent la cicatrisation endothéliale par l’activation directe de la signalisation membranaire de l’ERa dans l’endothélium, l’E4 active l’ERa nucléaire dans les CML sous-jacentes, induisant des signaux qui accélèrent la cicatrisation endothéliale [45]. Ces résultats ont révélé l’importance du dialogue entre les CML et les cellules endothéliales dans la cicatrisation endothéliale. Il est désormais nécessaire de déterminer dans quelle mesure ces mécanismes pourraient être préservés avec l’âge, ouvrant alors la voie à un renouveau, ou en tous cas, à un regain d’intérêt du traitement hormonal de la ménopause.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Mahmood SS, Levy D, Vasan RS, et al. The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective. Lancet 2014 ; 383 : 999–1008. [CrossRef] [PubMed] [Google Scholar]
- Newson L. Menopause and cardiovascular disease. Post Reprod Health 2018 ; 24 : 44–9. [CrossRef] [PubMed] [Google Scholar]
- Muka T, Oliver-Williams C, Kunutsor S, et al. Association of Age at Onset of Menopause and Time Since Onset of Menopause With Cardiovascular Outcomes, Intermediate Vascular Traits, and All-Cause Mortality: A Systematic Review and Meta-analysis. JAMA Cardiol 2016 ; 1 : 767–76. [CrossRef] [PubMed] [Google Scholar]
- Davezac M, Buscato M, Zahreddine R, et al. Estrogen Receptor and Vascular Aging. Front Aging 2021 ; 2 : 727380. [CrossRef] [PubMed] [Google Scholar]
- Anesi N, Miquel C-H, Laffont S, et al. The Influence of Sex Hormones and X Chromosome in Immune Responses. Curr Top Microbiol Immunol 2023 ; 441 : 21–59. [PubMed] [Google Scholar]
- Tramunt B, Smati S, Grandgeorge N, et al. Sex differences in metabolic regulation and diabetes susceptibility. Diabetologia 2020 ; 63 : 453–61. [CrossRef] [PubMed] [Google Scholar]
- Stampfer MJ, Colditz GA, Willett WC, et al. Postmenopausal estrogen therapy and cardiovascular disease. Ten-year follow-up from the nurses’ health study. N Engl J Med 1991 ; 325 : 756–62. [CrossRef] [PubMed] [Google Scholar]
- Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002 ; 288 : 321–33. [CrossRef] [PubMed] [Google Scholar]
- Rossouw JE, Prentice RL, Manson JE, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA 2007 ; 297 : 1465–1477. [CrossRef] [PubMed] [Google Scholar]
- Hodis HN, Mack WJ, Henderson VW, et al. Vascular Effects of Early versus Late Postmenopausal Treatment with Estradiol. N Engl J Med 2016 ; 374 : 1221–31. [CrossRef] [PubMed] [Google Scholar]
- Ellis S, Franks DW, Nielsen MLK, et al. The evolution of menopause in toothed whales. Nature 2024 ; 627 : 579–85. [CrossRef] [PubMed] [Google Scholar]
- Gilmer G, Hettinger ZR, Tuakli-Wosornu Y, et al. Female aging: when translational models don’t translate. Nat Aging 2023 ; 3 : 1500–8. [CrossRef] [PubMed] [Google Scholar]
- Hayashi T, Fukuto JM, Ignarro LJ, et al. Basal release of nitric oxide from aortic rings is greater in female rabbits than in male rabbits: implications for atherosclerosis. Proc Natl Acad Sci USA 1992 ; 89 : 11259–63. [CrossRef] [PubMed] [Google Scholar]
- Gisclard V, Miller VM, Vanhoutte PM. Effect of 17 beta-estradiol on endothelium-dependent responses in the rabbit. J Pharmacol Exp Ther 1988 ; 244 : 19–22. [PubMed] [Google Scholar]
- Wynne FL, Payne JA, Cain AE, et al. Age-Related Reduction in Estrogen Receptor-Mediated Mechanisms of Vascular Relaxation in Female Spontaneously Hypertensive Rats. Hypertension 2004 ; 43 : 405–12. [CrossRef] [PubMed] [Google Scholar]
- Nicholson CJ, Sweeney M, Robson SC, et al. Estrogenic vascular effects are diminished by chronological aging. Sci Rep 2017 ; 7 : 12153. [CrossRef] [PubMed] [Google Scholar]
- Guivarc’h E, Favre J, Guihot A-L, et al. Nuclear Activation Function 2 Estrogen Receptor α Attenuates Arterial and Renal Alterations Due to Aging and Hypertension in Female Mice. J Am Heart Assoc 2020 ; 9 : e013895. [CrossRef] [PubMed] [Google Scholar]
- Williams JK, Adams MR, Klopfenstein HS. Estrogen modulates responses of atherosclerotic coronary arteries. Circulation 1990 ; 81 : 1680–7. [CrossRef] [PubMed] [Google Scholar]
- Elhage R, Bayard F, Richard V, et al. Prevention of fatty streak formation of 17beta-estradiol is not mediated by the production of nitric oxide in apolipoprotein E-deficient mice. Circulation 1997 ; 96 : 3048–52. [CrossRef] [PubMed] [Google Scholar]
- Haarbo J, Leth-Espensen P, Stender S, et al. Estrogen monotherapy and combined estrogen-progestogen replacement therapy attenuate aortic accumulation of cholesterol in ovariectomized cholesterol-fed rabbits. J Clin Invest 1991 ; 87 : 1274–9. [CrossRef] [PubMed] [Google Scholar]
- Clarkson TB, Meléndez GC, Appt SE. Timing hypothesis for postmenopausal hormone therapy: its origin, current status, and future. Menopause 2013 ; 20 : 342–53. [CrossRef] [PubMed] [Google Scholar]
- Mikkola TS, Clarkson TB. Estrogen replacement therapy, atherosclerosis, and vascular function. Cardiovasc Res 2002 ; 53 : 605–19. [CrossRef] [PubMed] [Google Scholar]
- Cann JA, Register TC, Adams MR, et al. Timing of Estrogen Replacement Influences Atherosclerosis Progression and Plaque Leukocyte Populations in ApoE−/− Mice. Atherosclerosis 2008 ; 201 : 43. [CrossRef] [PubMed] [Google Scholar]
- Krasinski K, Spyridopoulos I, Asahara T, et al. Estradiol Accelerates Functional Endothelial Recovery After Arterial Injury. Circulation 1997 ; 95 : 1768–72. [CrossRef] [PubMed] [Google Scholar]
- Brouchet L, Krust A, Dupont S, et al. Estradiol Accelerates Reendothelialization in Mouse Carotid Artery Through Estrogen Receptor-α but Not Estrogen Receptor-β. Circulation 2001 ; 103 : 423–8. [CrossRef] [PubMed] [Google Scholar]
- Zahreddine R, Davezac M, Smirnova N, et al. Tamoxifen Accelerates Endothelial Healing by Targeting ERα in Smooth Muscle Cells. Circ Res 2020 ; 127 : 1473–87. [CrossRef] [PubMed] [Google Scholar]
- Gennaro G, Ménard C, Michaud S-E, et al. Age-dependent impairment of reendothelialization after arterial injury: role of vascular endothelial growth factor. Circulation 2003 ; 107 : 230–3. [CrossRef] [PubMed] [Google Scholar]
- Arnal J-F, Lenfant F, Metivier R, et al. Membrane and Nuclear Estrogen Receptor Alpha Actions: From Tissue Specificity to Medical Implications. Physiol Rev 2017 ; 97 : 1045–87. [CrossRef] [PubMed] [Google Scholar]
- Barton M, Filardo EJ, Lolait SJ, et al. Twenty years of the G protein-coupled estrogen receptor GPER: Historical and personal perspectives. J Steroid Biochem Mol Biol 2018 ; 176 : 4–15. [CrossRef] [PubMed] [Google Scholar]
- Kalluri AS, Vellarikkal SK, Edelman ER, et al. Single-Cell Analysis of the Normal Mouse Aorta Reveals Functionally Distinct Endothelial Cell Populations. Circulation 2019 ; 140 : 147–63. [CrossRef] [PubMed] [Google Scholar]
- Arnal J-F, Fontaine C, Billon-Galés A, et al. Estrogen Receptors and Endothelium. Arterioscler Thromb Vasc Biol 2010 ; 30 : 1506–12. [CrossRef] [PubMed] [Google Scholar]
- Billon-Galés A, Fontaine C, Douin-Echinard V, et al. Endothelial Estrogen Receptor-α Plays a Crucial Role in the Atheroprotective Action of 17β-Estradiol in Low-Density Lipoprotein Receptor-Deficient Mice. Circulation 2009 ; 120 : 2567–76. [CrossRef] [PubMed] [Google Scholar]
- Toutain CE, Filipe C, Billon A, et al. Estrogen receptor alpha expression in both endothelium and hematopoietic cells is required for the accelerative effect of estradiol on reendothelialization. Arterioscler Thromb Vasc Biol 2009 ; 29 : 1543–50. [CrossRef] [PubMed] [Google Scholar]
- Tarhouni K, Guihot AL, Freidja ML, et al. Key role of estrogens and endothelial estrogen receptor α in blood flow-mediated remodeling of resistance arteries. Arterioscler Thromb Vasc Biol 2013 ; 33 : 605–11. [CrossRef] [PubMed] [Google Scholar]
- Smirnova NF, Fontaine C, Buscato M, et al. The Activation Function-1 of Estrogen Receptor Alpha Prevents Arterial Neointima Development Through a Direct Effect on Smooth Muscle Cells. Circ Res 2015 ; 117 : 770–778. [CrossRef] [PubMed] [Google Scholar]
- Zimmerman MA, Budish RA, Kashyap S, et al. GPER-novel membrane oestrogen receptor. Clin Sci (Lond) 2016 ; 130 : 1005–16. [CrossRef] [PubMed] [Google Scholar]
- Peixoto P, Aires RD, Lemos VS, et al. GPER agonist dilates mesenteric arteries via PI3K-Akt-eNOS and potassium channels in both sexes. Life Sci 2017 ; 183 : 21–7. [CrossRef] [PubMed] [Google Scholar]
- Novensà L, Novella S, Medina P, et al. Aging Negatively Affects Estrogens-Mediated Effects on Nitric Oxide Bioavailability by Shifting ERα/ERβ Balance in Female Mice. PLoS One 2011 ; 6 : e25335. [CrossRef] [PubMed] [Google Scholar]
- Losordo DW, Kearney M, Kim EA, et al. Variable expression of the estrogen receptor in normal and atherosclerotic coronary arteries of premenopausal women. Circulation 1994 ; 89 : 1501–10. [CrossRef] [PubMed] [Google Scholar]
- Jones MJ, Goodman SJ, Kobor MS. DNA methylation and healthy human aging. Aging Cell 2015 ; 14 : 924–32. [CrossRef] [PubMed] [Google Scholar]
- Gardini ES, Chen GG, Fiacco S, et al. Differential ESR1 Promoter Methylation in the Peripheral Blood—Findings from the Women 40+ Healthy Aging Study. Int J Mol Sci 2020 ; 21 : 3654. [CrossRef] [PubMed] [Google Scholar]
- Gavin KM, Seals DR, Silver AE, et al. Vascular Endothelial Estrogen Receptor α Is Modulated by Estrogen Status and Related to Endothelial Function and Endothelial Nitric Oxide Synthase in Healthy Women. J Clin Endocrinol Metab 2009 ; 94 : 3513–20. [CrossRef] [PubMed] [Google Scholar]
- Tarhouni K, Guihot A-L, Vessières E, et al. Determinants of flow-mediated outward remodeling in female rodents: respective roles of age, estrogens, and timing. Arterioscler Thromb Vasc Biol 2014 ; 34 : 1281–9. [CrossRef] [PubMed] [Google Scholar]
- Adlanmerini M, Solinhac R, Abot A, et al. Mutation of the palmitoylation site of estrogen receptor α in vivo reveals tissue-specific roles for membrane versus nuclear actions. Proc Natl Acad Sci U S A 2014 ; 111 : E283–90. [CrossRef] [PubMed] [Google Scholar]
- Davezac M, Zahreddine R, Buscato M, et al. The different natural estrogens promote endothelial healing through distinct cell targets. JCI Insight 2023 ; 8 : e161284. [CrossRef] [PubMed] [Google Scholar]
- Fischer GM, Swain ML. Effects of estradiol and progesterone on the increased synthesis of collagen in atherosclerotic rabbit aortas. Atherosclerosis 1985 ; 54 : 177–85. [CrossRef] [PubMed] [Google Scholar]
- Haarbo J, Hansen BF, Christiansen C. Hormone replacement therapy prevents coronary artery disease in ovariectomized cholesterol-fed rabbits. APMIS 1991 ; 99 : 721–7. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Principales études expérimentales rapportant l’effet de l’âge ou du statut oestrogénique sur les effets vasculaires chez la femelle. ND : non déterminé ; Ovx : ovariectomisée ; E2 : 17β-estradiol ; CEE : conjugated equine estrogens.
Liste des figures
 |
Figure 1. Effets non exhaustifs des œstrogènes dans la prévention du risque cardiovasculaire. Alors que les effets bénéfiques des œstrogènes endogènes sont bien établis chez la femme jeune, une question clé reste en suspens : dans quelle mesure ces effets peuvent être préservés à la ménopause par un apport d’œstrogènes exogènes dans le cadre du traitement hormonal de la ménopause (THM) ? |
| Dans le texte | |
 |
Figure 2. Évolution de la compréhension de l’impact des œstrogènes sur l’incidence des maladies cardiovasculaires à travers les études cliniques. Initialement, les traitements hormonaux de la ménopause (THM) étaient largement prescrits en raison de leur capacité à soulager les symptômes et à prévenir les maladies chroniques associées au vieillissement, y compris les maladies cardiovasculaires (MCV). Alors que les effets bénéfiques des œstrogènes sur les MCV sont bien établis dans les organismes jeunes, la question de savoir si un apport d’œstrogènes exogènes protège du risque accru de MCV associé à la ménopause n’est toujours pas résolue. Ce point fait débat depuis les conclusions du grand essai clinique de la Women’s Health Initiative (WHI), révélant une augmentation des MCV chez les femmes sous traitement hormonal de la ménopause. Les nouvelles analyses de cette étude nuancent toutefois cette conclusion, en rapportant un effet « timing » avec une protection du risque coronarien par les œstrogènes exogènes chez les femmes traitées avant 60 ans mais un impact délétère de ces hormones chez les femmes ayant reçu ce traitement plus tardivement. |
| Dans le texte | |
 |
Figure 3. Mécanisme d’action du récepteur des œstrogènes (ERα). Action nucléaire d’ERα : la fixation du 17-β œstradiol (E2) à ERα présent dans le cytoplasme déclenche des changements conformationnels du récepteur qui conduisent à sa translocation nucléaire et à sa fixation sur des séquence d’ADN spécifiques. Une fois fixé au promoteur de ses gènes cibles, ERα. initie leur transcription en recrutant des coactivateurs. Action membranaire de ERα : après palmitoylation, ERα peut également se localiser à la membrane plasmique et initier une cascade de signalisation stéroïdienne rapide initiée par la membrane (ERαMISS) en interagissant avec différentes protéines, telles que Gαi, Src, PI3K (phosphoinositide 3-kinase) et eNOS (NO synthase endothéliale). La dilatation de l’endothélium et la ré-endothélialisation dépendent de l’action membranaire d’ERα, tandis que la prévention de l’athérosclérose dépend de l’action nucléaire d’ERα. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




