| Numéro |
Med Sci (Paris)
Volume 40, Numéro 10, Octobre 2024
|
|
|---|---|---|
| Page(s) | 770 - 773 | |
| Section | Repères | |
| DOI | https://doi.org/10.1051/medsci/2024105 | |
| Publié en ligne | 25 octobre 2024 | |
Sclérose en plaques, les espoirs de la recherche
Multiple sclerosis: The hopes of research
1
Centre interdisciplinaire de recherche en biologie (CIRB), Collège de France, CNRS, Inserm, Université PSL Paris France
2
Sorbonne université, APHP hôpital de la Pitié-Salpêtrière et Institut du cerveau, Centre d’Investigation Clinique Neurosciences Paris France
3
Sorbonne université, Institut du cerveau – Paris Brain Institute – ICM, Inserm, CNRS, APHP, Hôpital de la Pitié-Salpêtrière, DMU Neuroscience Paris France
4
Fondation France sclérose en plaques Ivry sur Seine France
*
armelle.rancillac@college-de-france.fr
Pour la 26e édition de la Semaine du Cerveau, en partenariat avec la Fondation France sclérose en plaques et le Club des Cellules Gliales, une conférence sur la sclérose en plaques a été organisée au Collège de France pour sensibiliser le grand public à cette maladie. Céline Louapre et Brahim Nait Oumesmar ont présenté un état des lieux des connaissances actuelles sur cette maladie et les espoirs de la recherche en matière de perspectives thérapeutiques. Cette conférence a été associée à un moment d’échange autour de stands d’information et de posters présentés par des jeunes chercheurs financés par la fondation.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Inserm – Alice Lieury)
La sclérose en plaques
La sclérose en plaques est une maladie inflammatoire auto-immune du système nerveux central, qui affecte la substance blanche. Elle a été décrite pour la première fois, sur le plan clinique et anatomique, par Jean-Martin Charcot et Alfred Vulpian en 1866. La Fédération internationale des sociétés de sclérose en plaques estime que la maladie touche environ 2,9 millions de personnes dans le monde, soit environ une personne sur 2 000, avec 134 000 cas en France. Cette maladie se manifeste généralement entre 20 et 40 ans, par des troubles divers : sensitifs, cognitifs, de l’équilibre ou encore moteurs, visuels, etc. Une assistance à la marche devient nécessaire 18 ans en moyenne après l’annonce du diagnostic. Par ailleurs, des troubles cognitifs sont observés chez 43 % à 65 % des patients. Bien que les causes exactes restent inconnues, des facteurs environnementaux et génétiques sont reconnus comme prédisposants à cette maladie [1] (Encadré 1).
Dans la sclérose en plaques, le système immunitaire est dérégulé et s’attaque à la gaine de myéline, un revêtement protecteur entourant de nombreux axones. Cette gaine est formée par l’enroulement concentrique des prolongements des oligodendrocytes, une structure membranaire qui accélère la conduction nerveuse, la rendant jusqu’à cent fois plus rapide. Ainsi, la dégradation de la gaine de myéline dans la sclérose en plaques ralentit la transmission de l’information nerveuse. Les zones du système nerveux affectées par l’inflammation se présentent sous forme de lésions « en plaques », qui peuvent évoluer en cicatrices et induire une neurodégénérescence.
Évolution de la sclérose en plaques
La sclérose en plaques peut se déclencher de deux manières, soit par poussées (forme « rémittente-récurrente ») dans 85 % des cas, soit par l’apparition et la progression d’un handicap (forme « primaire-progressive ») dans 15 % des cas. La forme rémittente se manifeste par la survenue de poussées caractérisées par l’apparition de symptômes neurologiques, et qui sont suivies de périodes de rémission pendant lesquelles les symptômes s’atténuent voire disparaissent. Les poussées peuvent durer de quelques jours à quelques semaines, avec une variabilité dans la sévérité et la durée des symptômes d’une poussée à l’autre selon les régions cérébrales touchées. Cette forme évolue dans 50 % des cas vers une forme secondairement progressive, dans laquelle les handicaps s’aggravent progressivement. Des poussées peuvent encore survenir dans cette phase. Dans les formes primaires progressives de la sclérose en plaques, la maladie progresse graduellement sans véritables périodes de rémission. La progression de la sclérose en plaques est très variable, ce qui rend difficile la prédiction de l’évolution de la maladie pour un patient donné.
① La sclérose en plaques est une maladie auto-immune qui affecte le système nerveux central
Plusieurs facteurs de risque contribuent à la susceptibilité de développer cette maladie :
Le sexe. Les femmes sont deux à trois fois plus susceptibles que les hommes de développer la maladie [2].
La latitude géographique. La maladie est plus fréquente chez les personnes vivant loin de l’équateur. Cela est souvent attribué à des niveaux plus bas de vitamine D car l’exposition au soleil, qui permet la synthèse cutanée de vitamine D, diminue avec l’éloignement de l’équateur [3].
L’infection par le virus d’Epstein-Barr. Cette infection, responsable de la mononucléose infectieuse, a été associée à un risque accru de développer une sclérose en plaques [4,11] (→). En effet, si 90 % de la population générale a été infectée par ce virus, 100 % des personnes atteintes de sclérose en plaques l’ont été. L’infection par ce virus est donc nécessaire, mais non suffisante pour déclencher la maladie.
La génétique. Bien qu’il n’existe pas de « gène de la sclérose en plaques », avoir un membre de la famille proche atteint de la sclérose en plaques augmente le risque de développer la maladie.
Le tabagisme et l’obésité. Ces facteurs augmentent le risque de développer la maladie [5,6].
(→) Voir la Nouvelle d'E. Manet et H. Gruffat, m/s n° 5, mai 2022, page 422
Ces facteurs de risque ne permettent pas de prédire la survenue d’une sclérose en plaques. De nombreuses personnes exposées à ces facteurs de risque ne développeront jamais la maladie, tandis que d’autres, sans facteur de risque évident, peuvent en être atteintes.
Les traitements actuels
Après plus de trente ans de recherche sur la sclérose en plaques [7], les traitements actuels reposent principalement sur des immunosuppresseurs et immunomodulateurs, qui réduisent la fréquence des poussées. Mais ils sont encore insuffisants pour stopper la progression de la maladie. En effet, l’observation des zones d’inflammation, ou plaques, grâce à l’imagerie par résonance magnétique à haute définition, a permis de montrer que les anciennes lésions conservent une activité inflammatoire, particulièrement délétère, qui conduit à une progression discrète de la maladie. Toutefois, cette technique d’imagerie cérébrale a également permis de mettre en évidence l’existence de zones de remyélinisation, très variables selon les patients et les régions du cerveau.
Actuellement, les stratégies de traitement ciblent le système immunitaire pour lutter contre l’inflammation. Il existe sur le marché une quinzaine de médicaments qui ciblent le système immunitaire [8], mais aucun traitement ne cible directement le système nerveux central. De nombreux essais cliniques sont en cours pour explorer de nouvelles approches thérapeutiques. Le premier évènement dans le déclenchement d’une lésion active est l’infiltration de cellules inflammatoires, notamment des monocytes et des macrophages, ainsi que des lymphocytes B et T, qui attaquent la myéline. Cette lésion évolue ensuite en lésion chronique active, caractérisée par une inflammation, une extension de la lésion, et une perte importante de myéline. À terme, en l’absence de réparation de la myéline, la lésion se transforme en lésion chronique inactive, où les astrocytes forment une cicatrice gliale. C’est à ce stade qu’on observe une neurodégénérescence [9], avec la perte des fibres nerveuses, entraînant une progression du handicap neurologique. Parallèlement, un processus de remyélinisation se met en place, mobilisant les cellules précurseurs d’oligodendrocytes réactivées. Ces cellules prolifèrent, migrent vers la zone lésée lors de la phase de recrutement, puis se différencient en oligodendrocytes, amorçant ainsi le processus de remyélinisation. Malheureusement, l’efficacité de ce processus spontané de réparation est variable selon les individus et tend à diminuer avec l’âge (Figure 1).
 |
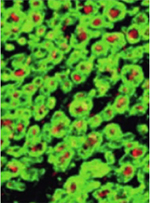
Figure 1. Formation d’une lésion chronique. Le premier évènement est l’ouverture de la barrière hémato-encéphalique. 1. Les lymphocytes T et B (en rouge) et macrophages (en cyan) traversent alors la barrière hémato-encéphalique et pénètrent dans le système nerveux central. 2. Ils attaquent la myéline, qui entoure les axones (vert), et forment une lésion active de démyélinisation. Au fil du temps, l’inflammation diminue et les macrophages ont nettoyé les débris myéliniques. 3. On parle alors de lésion chronique active. La perte de myéline peut entraîner une dégénérescence des axones, aggravant les dommages neurologiques. Les oligodendrocytes (en bleu) tentent de remyéliniser les axones. Cependant, cette réparation est souvent incomplète. Les astrocytes (un autre type de cellules gliales) prolifèrent et forment une cicatrice gliale (gliose cicatricielle, en jaune), stabilisant ainsi la zone, mais empêchant une régénération complète. 4. On parle alors de lésion chronique inactive. |
Les axes de recherche
Comprendre le mécanisme de régénération de la gaine de myéline constitue un objectif de recherche crucial dans le contexte de la sclérose en plaques [8] (→).
(→) Voir la Synthèse de C. Louapre et al., m/s n° 12, décembre 2013, page 1105
En effet, avec la progression de la sclérose en plaques, la remyélinisation perd en efficacité, en plus de diminuer naturellement avec l’âge. Améliorer ce processus représente donc un défi majeur pour freiner la progression de la maladie. De nombreuses équipes de recherche ont pour objectif de décrypter les étapes de la remyélinisation, pour comprendre son processus, et pour identifier des cibles (moléculaires ou cellulaires) susceptibles d’être manipulées pour le rendre plus efficace. Parallèlement, des stratégies d’imagerie innovantes pour suivre le processus sont en cours de développement.
Les recherches actuelles se concentrent également sur le développement de stratégies pharmacologiques visant à promouvoir la remyélinisation (Figure 2). Ces approches devraient permettre d’améliorer les capacités de régénération de la myéline et, par conséquent, de ralentir la progression de la maladie.
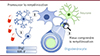 |
Figure 2. Les objectifs actuels de la recherche visent à freiner la progression de la sclérose en plaques en ciblant la remyélinisation. Mieux comprendre les différentes étapes de ce processus régénératif, incluant le recrutement des cellules précurseurs d’oligodendrocytes (1), leur différenciation (2) et leur maturation en oligodendrocytes remyélinisants (3), pour identifier des cibles thérapeutiques et développer des stratégies pharmacologiques de remyélinisation. |
Parmi les avancées en recherche, les mécanismes de la différenciation des cellules progénitrices d’oligodendrocytes en oligodendrocytes remyélinisants sont désormais mieux compris. Des facteurs de transcription, tels que Olig2 ou Sox10, favorisent cette différenciation. De plus, l’expression du récepteur nucléaire RXR-γ est un élément déterminant dans ce processus. Ces facteurs sont d’ailleurs exprimés dans les lésions caractéristiques de la sclérose en plaques, ce qui indique leur rôle potentiel dans la régénération de la myéline et offre de nouvelles pistes pour le développement de thérapies ciblées (Encadré 2).
Il est également établi que la remyélinisation est contrôlée par l’activité des fibres nerveuses [10]. La libération de neurotransmetteurs joue en effet un rôle clé dans le contrôle de la myélinisation. Ainsi, stimuler l’activité électrique après l’apparition d’une lésion peut accélérer le processus de remyélinisation. Un essai clinique mené par Céline Louapre est actuellement en cours pour explorer cette piste de l’activité électrique.
Enfin, la découverte de molécules pro-myélinisantes, identifiées par criblage moléculaire dans des cultures cellulaires de précurseurs d’oligodendrocytes, ouvre la voie vers des essais dans des modèles précliniques de lésions de la myéline. Ces molécules, principalement issues du repositionnement de composés existants, ont été sélectionnées parmi 1 500 candidats, grâce à des analyses bio-informatiques visant à prédire leur effet sur la myélinisation et la neuroprotection. Après les tests en culture cellulaire, l’efficacité de ces molécules a également été évaluée in vivo chez la souris, ce qui a permis d’identifier des molécules prometteuses pour favoriser la remyélinisation et la neuroprotection. Plusieurs d’entre elles pourraient bientôt faire l’objet d’essais cliniques. Cette approche, combinée au progrès de l’imagerie par tomographie par émission de positons pour étudier la démyélinisation et la remyélinisation, ouvre des perspectives thérapeutiques innovantes et encourageantes dans le traitement de la sclérose en plaques.
② Objectifs de la recherche pour freiner la progression de la sclérose en plaques en ciblant la remyélinisation
Comprendre les différentes étapes de la remyélinisation
Identifier des cibles thérapeutiques impliquées dans le contrôle de la réparation de la myéline
Développer des techniques innovantes d’imagerie permettant de suivre la remyélinisation
Développer des stratégies pharmacologiques pour promouvoir la remyélinisation
③ France sclérose en plaques : une nouvelle fondation pour la recherche et l’aide aux patients
La fondation France sclérose en plaques a été créée le 15 mai 2024. Elle résulte de la fusion de la Fondation pour l’Aide à la recherche sur la Sclérose en plaques (Fondation ARSEP), la Ligue française contre la sclérose en plaques (LFSEP), et l’Union pour la lutte contre la sclérose en plaques (Unisep). Chacune de ces trois structures œuvrait auparavant en France et à l’étranger pour lutter contre la sclérose en plaques, en finançant la recherche, en accompagnant les patients et en sensibilisant le grand public à cette maladie.
La création de France sclérose en plaques marque une étape importante dans la lutte contre cette maladie, en unifiant les efforts et les ressources pour maximiser l’impact de la recherche et le soutien aux patients et aux aidants.
Perspectives
Les progrès réalisés dans la compréhension des mécanismes de démyélinisation et de remyélinisation s’insèrent dans un cadre plus large de défis que la recherche sur la sclérose en plaques doit relever (Encadré 3) : comprendre l’impact du microbiote intestinal sur l’inflammation, déterminer le rôle de certains gènes dans l’augmentation du risque de la maladie, analyser les facteurs environnementaux impliqués dans sa survenue et dans son évolution, développer des stratégies pour empêcher la dégradation de la gaine de myéline.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Walton C, King R, Rechtman L, et al. Rising prevalence of multiple sclerosis worldwide: Insights from the Atlas of MS, third edition. Mult Scler J 2020 ; 26 : 1816–21. [CrossRef] [PubMed] [Google Scholar]
- Coyle PK. What can we learn from sex differences in multiple sclerosis? J Pers Med 2021 ; 11 : 1006. [CrossRef] [PubMed] [Google Scholar]
- Ghareghani M, Zibara K, Rivest S. Melatonin and vitamin D, two sides of the same coin, better to land on its edge to improve multiple sclerosis. Proc Natl Acad Sci USA. 2023 ; 120 : e2219334120. [CrossRef] [PubMed] [Google Scholar]
- Soldan SS, Lieberman PM. Epstein–Barr virus and multiple sclerosis. Nat Rev Microbiol 2023 ; 21 : 51–64. [CrossRef] [PubMed] [Google Scholar]
- Marrodan M, Farez MF, Balbuena Aguirre ME, Correale J. Obesity and the risk of multiple sclerosis. The role of leptin. Ann Clin Transl Neurol 2021 ; 8 : 406–24. [CrossRef] [PubMed] [Google Scholar]
- Manouchehrinia A, Huang J, Hillert J, et al. Smoking attributable risk in multiple sclerosis. Front Immunol 2022 ; 13 : 840158. [CrossRef] [PubMed] [Google Scholar]
- Tintore M, Vidal-Jordana A, Sastre-Garriga J. Treatment of multiple sclerosis: success from bench to bedside. Nat Rev Neurol 2019 ; 15 : 53–8. [CrossRef] [PubMed] [Google Scholar]
- Louapre C, Maillart É, Papeix C, Lubetzki C. Nouveautés thérapeutiques et stratégies émergentes dans la sclérose en plaques. Med Sci (Paris) 2013 ; 29 : 1105–10. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Michel L, Maugendre M, Masson MA, Nait-Oumesmar B. Comment le cerveau et la moelle sont-ils touchés dans la SEP ? Le point sur la sclérose en plaques et maladies apparentées en 2024. Paris : édition Edimark. 2024 : 105–128. [Google Scholar]
- Ortiz FC, Habermacher C, Graciarena M, et al. Neuronal activity in vivo enhances functional myelin repair. JCI Insight 2019 ; 4 : e123434. [CrossRef] [Google Scholar]
- Manet E, Gruffat H. Le virus d’Epstein-Barr – Un acteur clé dans le développement de la sclérose en plaques. Med Sci (Paris) 2022 ; 38 : 422–4. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Formation d’une lésion chronique. Le premier évènement est l’ouverture de la barrière hémato-encéphalique. 1. Les lymphocytes T et B (en rouge) et macrophages (en cyan) traversent alors la barrière hémato-encéphalique et pénètrent dans le système nerveux central. 2. Ils attaquent la myéline, qui entoure les axones (vert), et forment une lésion active de démyélinisation. Au fil du temps, l’inflammation diminue et les macrophages ont nettoyé les débris myéliniques. 3. On parle alors de lésion chronique active. La perte de myéline peut entraîner une dégénérescence des axones, aggravant les dommages neurologiques. Les oligodendrocytes (en bleu) tentent de remyéliniser les axones. Cependant, cette réparation est souvent incomplète. Les astrocytes (un autre type de cellules gliales) prolifèrent et forment une cicatrice gliale (gliose cicatricielle, en jaune), stabilisant ainsi la zone, mais empêchant une régénération complète. 4. On parle alors de lésion chronique inactive. |
| Dans le texte | |
 |
Figure 2. Les objectifs actuels de la recherche visent à freiner la progression de la sclérose en plaques en ciblant la remyélinisation. Mieux comprendre les différentes étapes de ce processus régénératif, incluant le recrutement des cellules précurseurs d’oligodendrocytes (1), leur différenciation (2) et leur maturation en oligodendrocytes remyélinisants (3), pour identifier des cibles thérapeutiques et développer des stratégies pharmacologiques de remyélinisation. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




