Figure 1.
Télécharger l'image originale
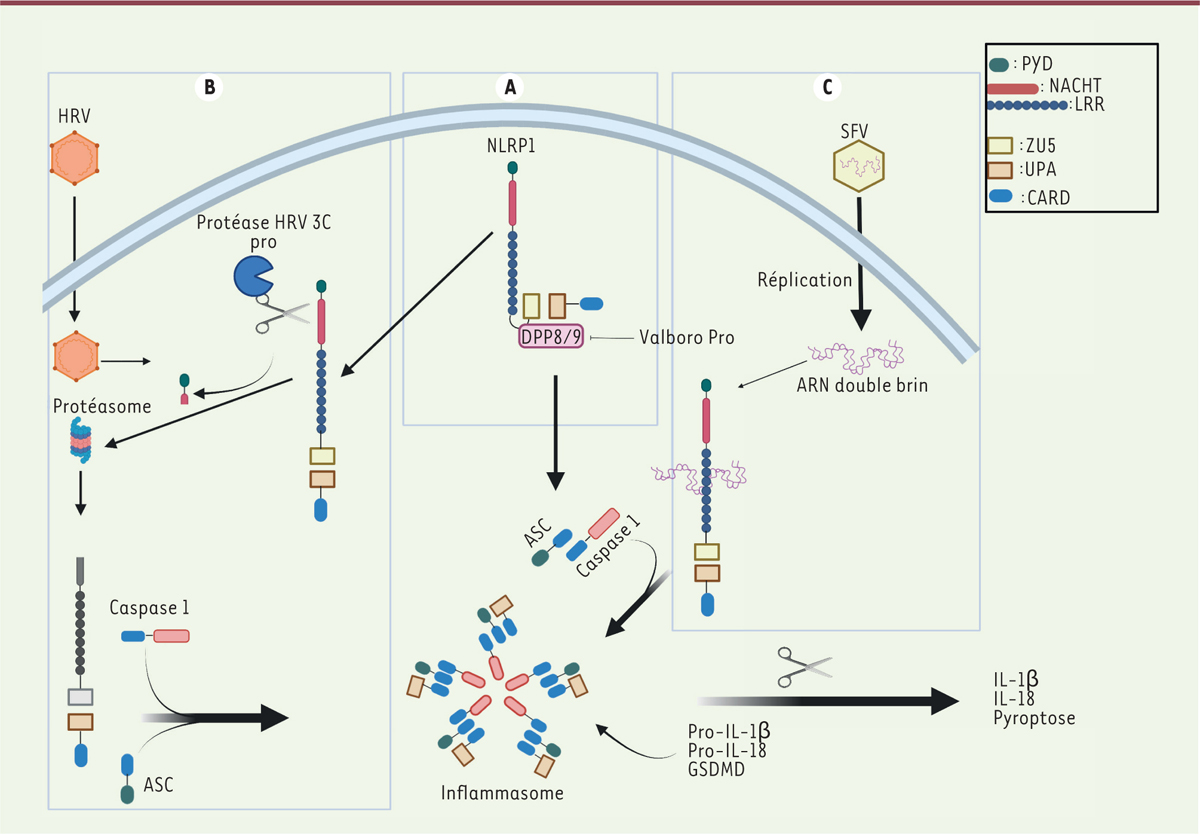
Schéma représentant l’activation de NLRP1 et la formation de l’inflammasome après activation par les rinovirus (HRV) ou le Semliki Forrest virus (SFV). A. NLRP1 est composé d’un domaine PYD suivi du domaine central NACHT puis des domaines ZU5, UPA et CARD. La présence d’une séquence SF1212/S 1213 entre les domaines ZU5 et UPA induit l’autoprotéolyse de la protéine, et les fragments générés sont maintenus dans une conformation inactive par les DDP8/9. Le Val-boro-Pro, en inhibant les DPP8/9, conduit à la formation de l’inflammasome NLRP1. B. Activation de l’inflammasome par la protéine 3C du HRV. La libération de la protéase 3C lors de la phase de réplication du virus clive la partie N-terminale de NLRP1, ce qui conduit à la dégradation de cette partie N-terminale. Le fragment libre UPA-CARD de NLRP1 s’oligomérise, recrute ASC et la caspase-1 pour former l’inflammasome. C. Activation de l’inflammasome par l’ARN réplicatif du SFV. La réplication du virus SFV induit sa détection par NLRP1 et, en conséquence, la formation de l’inflammasome. L’assemblage de l’inflammasome conduit à l’activation de la caspase-1 et au clivage de ses substrats proIL-1β, proIL-18 et GSDMD. Le clivage de cette dernière induit la pyroptose et la sécrétion des formes actives d’IL-1β et IL-18. PYD : pyrin domain ; NACHT: domaine présent dans les protéines NAIP, CIITA, HET-E and TP1 ; LRR : leucine-rich repeat ; CARD : caspase recruitement domain ; UPA : domaine trouvé dans les protéines UNC5, PIDD et Ankirine ; ZU5 : domaine trouvé dans les protéines ZO-1 et UNC (figure conçue avec Biorender.com).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




