Figure 1.
Télécharger l'image originale
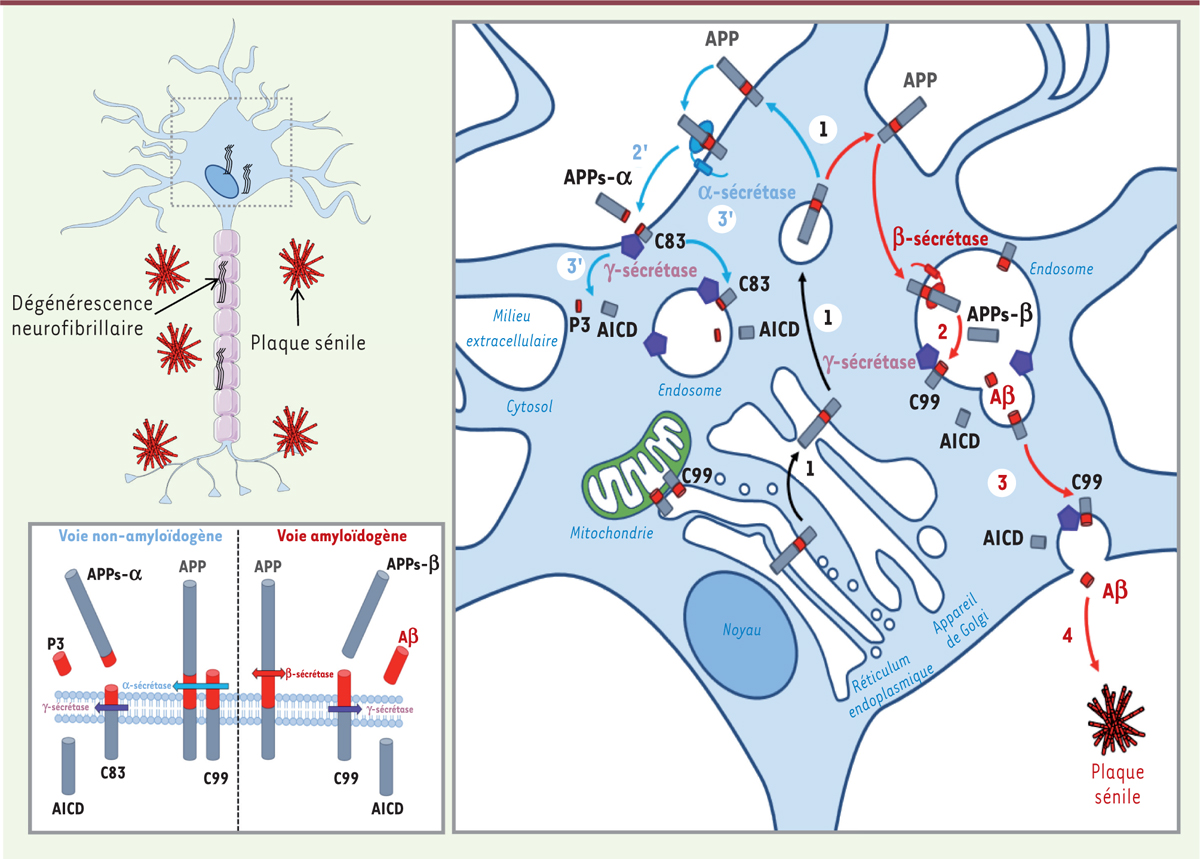
Représentation schématique de deux voies de protéolyse de l’APP : amyloïdogène (1 à 4) et non-amyloidogène (1 à 3’). Dans les conditions physiologiques, l’APP mature est adressée à la membrane plasmique (1), produisant, après clivage par l’α-sécrétase (2’), le fragment soluble APPs-α et le fragment C83, qui reste ancré à la membrane. Ce dernier est ensuite clivé par la γ–secrétase (3’), produisant les peptides p3 et AICD (APP intracellular domain). Par ailleurs, l’APP mature (1) est clivée par la β-sécrétase (2) après son internalisation dans la voie des endosomes/lysosomes, produisant le fragment soluble APPs-β, qui est libéré dans l’environnement extracellulaire, et le fragment C99 qui reste ancré dans la membrane et est ensuite clivé par la γ-secrétase (3), produisant les peptides AICD et Aβ. La voie amyloïdogène est favorisée dans les formes familiales de la maladie d’Alzheimer. Dans les formes sporadiques, la baisse de la dégradation des peptides Aβ peut conduire à leur accumulation, à leur agrégation et à la formation des plaques séniles. Nous avons rapporté la présence et le clivage de l’APP dans les membranes associées aux mitochondries, et l’accumulation du fragment C99 dans la mitochondrie [7].
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




