Figure 4.
Télécharger l'image originale
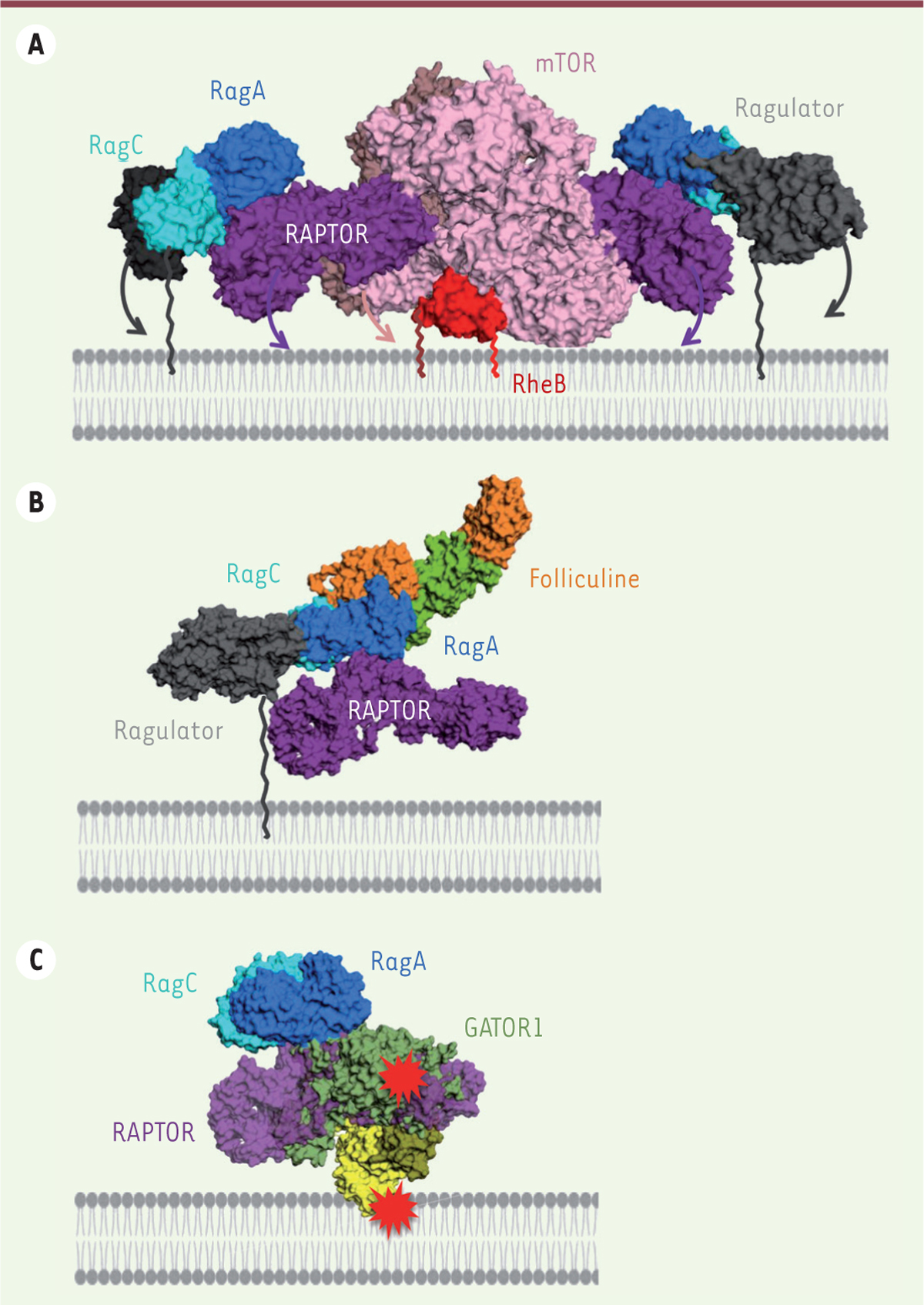
Architecture et régulation de mTOC1 à la membrane du lysosome : de nouvelles perspectives ouvertes par l’élucidation des structures. A. Modèle quasi-atomique du complexe mTORC1 activé, à la membrane du lysosome, reconstitué à partir de structures partielles du complexe [10, 14]. Le complexe étant un dimère, il est ancré à la membrane par quatre modifications lipidiques (indiquées par des lignes brisées). La surface de mTORC1 qui fait face à la membrane est étendue et assez plane, ce qui suggère que le complexe pourrait former des interactions directes avec la membrane. Ces interactions pourraient à leur tour induire des mouvements au sein du complexe (flèches), amplifiant ainsi l’activation. B. La superposition du complexe Ragulator/Rag/RAPTOR (PDB 6U62, [12]) avec le complexe Rag/folliculine (PDB 6ULG, [13]) montre que la folliculine est compatible avec l’assemblage du complexe mTORC1 à la membrane, suggérant la possibilité d’un effet « feedforward » au cours duquel tous les composants sont présents simultanément. C. La superposition du complexe Ragulator/Rag/RAPTOR avec le complexe Rag/GATOR1 (PDB 6CES [11]) montre que la fixation de GATOR1 n’est pas compatible avec celle de RAPTOR, ni potentiellement avec l’association de l’hétérodimère Rag avec la membrane, posant la question de l’environnement dans lequel GATOR1 exerce son action. Les régions en conflit stérique sont indiquées par le symbole rouge.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




