Figure 2.
Télécharger l'image originale
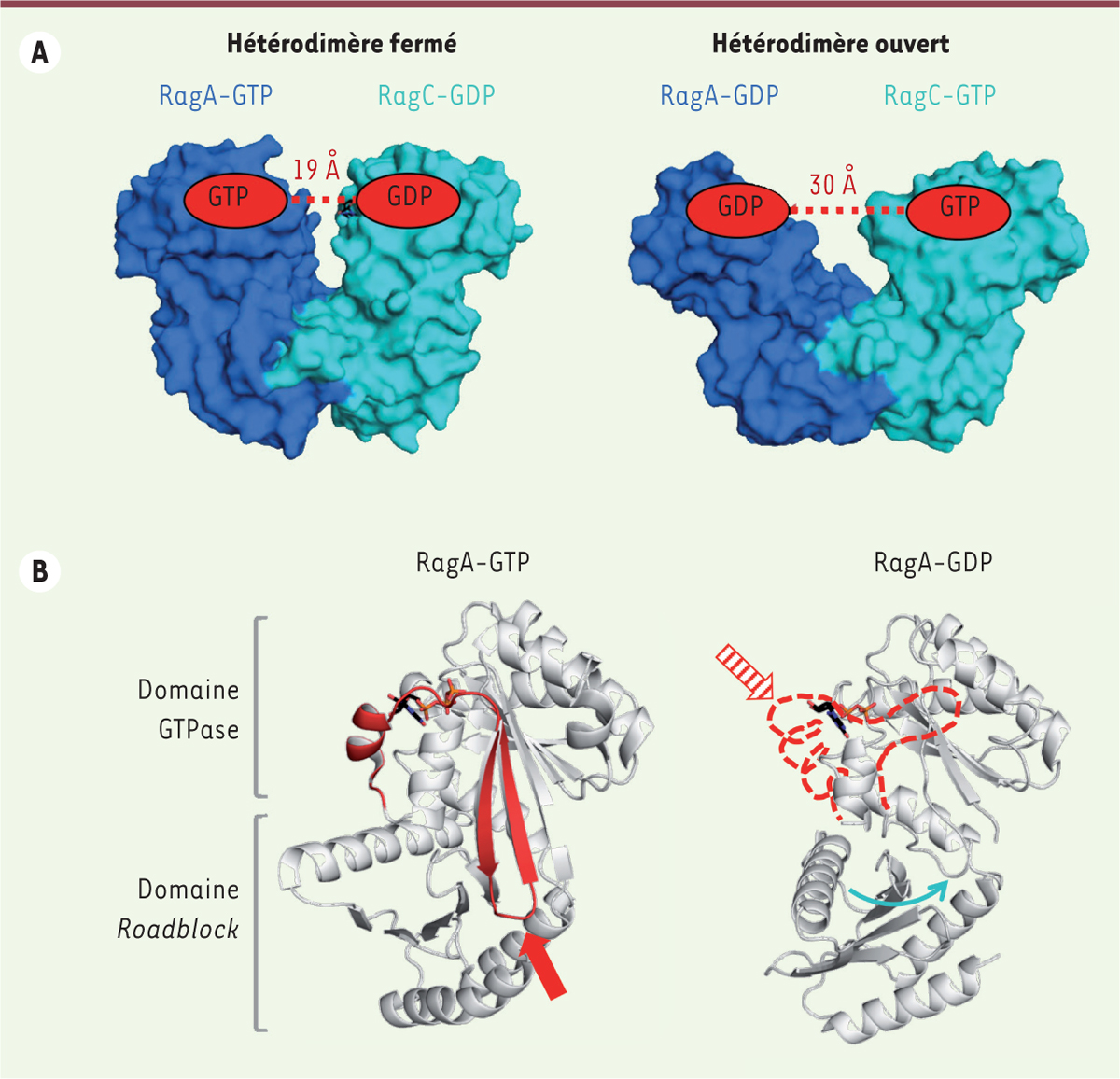
L’état nucléotidique des GTPases Rag contrôle l’assemblage du complexe mTORC1. A. La largeur de l’ouverture entre les domaines GTPases au sein de l’hétérodimère RagA/RagC dépend des nucléotides GDP et GTP. La forme la plus fermée fixe l’adaptateur RAPTOR, ce qui conduit au recrutement de mTOR à la membrane du lysosome, alors que la forme ouverte défavorise cette interaction. B. Dans la forme liée au GTP (PDB 6S6A, [14]), la région switch 1 interagit fortement avec le nucléotide et la région interswitch traverse le domaine GTPase entre le site nucléotidique et le domaine Roadblock (en rouge). Dans la forme liée au GDP (PDB 6ULG, [13]), ces deux régions sont très flexibles et désordonnées dans la structure (en pointillé rouge). Cette transition entre un état structuré, qui pousse sur le domaine Roadblock (flèche rouge pleine), et une forme flexible, qui relâche la pression (flèche rouge hachurée), explique comment le nucléotide agit à distance pour modifier la position du domaine Roadblock par rapport au domaine GTPase (flèche bleue).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




