Figure 3.
Télécharger l'image originale
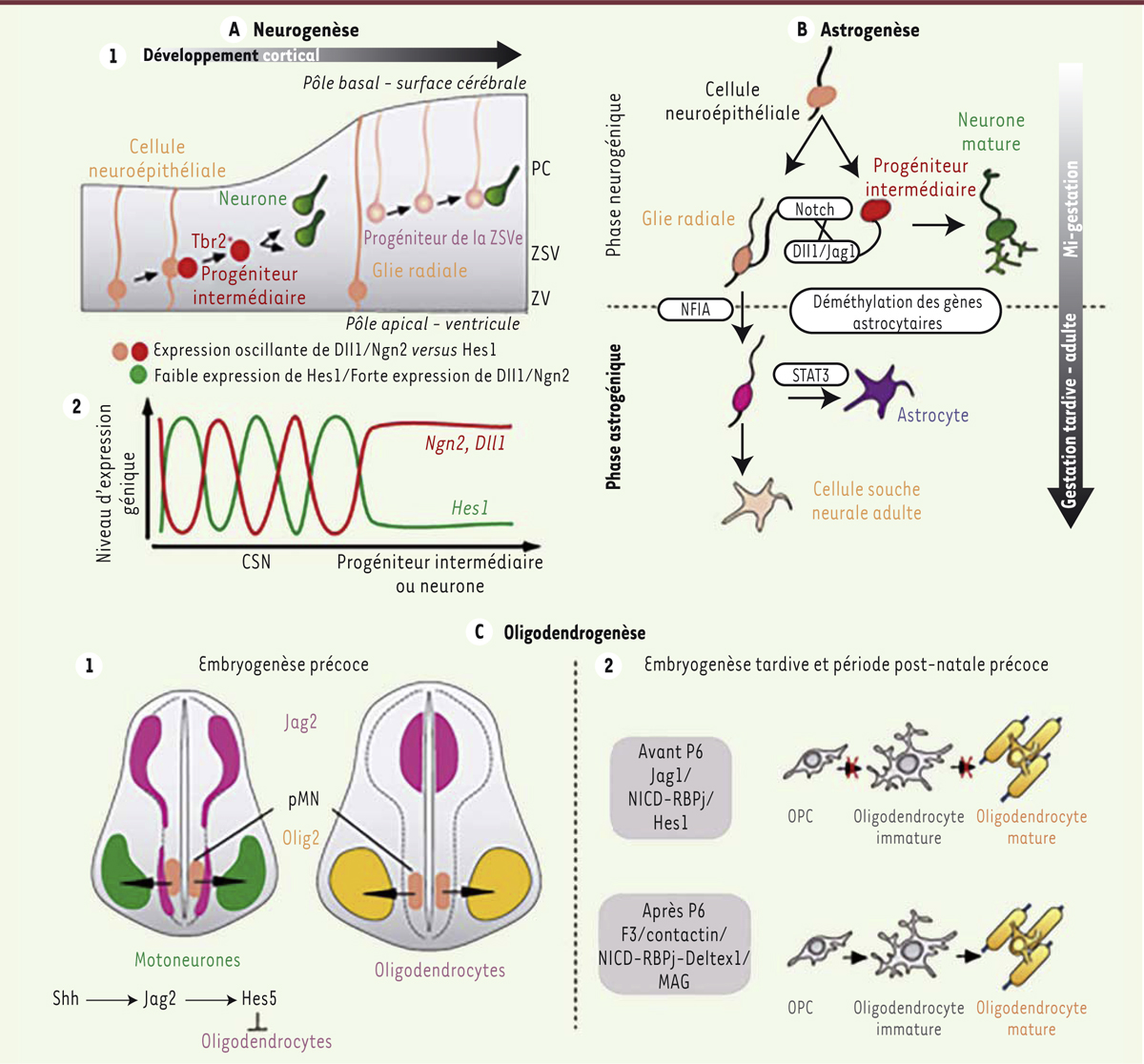
Signalisation Notch et production des neurones, astrocytes et oligodendrocytes au cours du développement embryonnaire. A-1. Dans le télencéphale embryonnaire dorsal, les cellules neuroépithéliales de la zone ventriculaire (ZV) subissent d’abord des divisions symétriques, puis se divisent de façon asymétrique pour donner des neurones ou des progéniteurs neuraux intermédiaires qui migrent respectivement dans la plaque corticale (PC) et la zone sous-ventriculaire (ZSV). Les progéniteurs neuraux intermédiaires continuent à se diviser dans la ZSV pour produire plus de neurones. Les cellules neuroépithéliales deviennent des cellules de la glie radiale dont certaines se différencient en progéniteurs de la ZSV externe (ZSVe), qui émettent un prolongement uniquement vers le versant basal. A-2. Dans les CSN (cellules souches neurales), les oscillations de Hes1 (hairy and enhancer of Split 1) contrôlent celles de Ngn2 (Neurogenin 2). Les oscillations de Dll1 (Delta-like protein 1) sont cycliquement induites par Ngn2 et réprimées par Hes1. Lorsque l’expression de Hes1 disparaît, celle de Ngn2 est induite de façon continue, ce qui déclenche la différenciation neuronale. B. À mi-parcours de la gestation, les cellules neuroépithéliales se divisent de manière asymétrique et génèrent un progéniteur neural intermédiaire de type neuronal et une cellule de la glie radiale. Les progéniteurs neuraux intermédiaires, qui se différencieront ultérieurement en neurones, expriment les ligands de Notch qui vont activer les récepteurs Notch sur la glie radiale avoisinante. Cela permet l’induction de la transcription du facteur NFIA (nuclear factor IA) nécessaire à la déméthylation du promoteur des gènes spécifiques des astrocytes. Le promoteur déméthylé est alors capable de lier STAT3 (signal transducer and activator of transcription 3), qui active la transcription du gène astrocytaire. Alternativement, les cellules de la glie radiale peuvent devenir des CSN adultes de type astrocytaire. C-1. Dans la partie ventrale du tube neural, le domaine pMN (progenitor domain of motoneurons) contient des progéniteurs Olig2+ (rose) qui génèrent successivement des motoneurones (vert) et des oligodendrocytes (orange). Lorsqu’il est exprimé dans le domaine pMN, Jag2 maintient les progéniteurs de la partie latérale de ce domaine dans un état indifférencié, alors que les progéniteurs proches de la ligne médiane qui ne sont pas en contact avec Jag2 se différencient en motoneurones. Pendant cette phase neurogénique, Hes5 induit par Jag2, lui-même contrôlé par le morphogène Sonic Hedgehog (Shh), empêche la différenciation prématurée des progéniteurs de la partie latérale de pMN en cellules oligodendrocytaires. À l’issue de cette phase, l’absence d’expression de Jag2 dans le domaine pMN autorise l’oligodendrogenèse. C-2. Au cours de l’embryogenèse tardive jusqu’au sixième jour post-natal (P6), la voie Notch canonique est activée par le ligand Jag1 et induit la transcription de Hes1 qui empêche la maturation des OPC (oligodendrocyte progenitor cells). Après P6, la voie Notch non canonique est activée par le ligand F3/contactine et induit la transcription du gène codant la glycoprotéine associée à la myéline (MAG [myelin-associated glycoprotein]) et par conséquent la différenciation des OPC.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




