Figure 2.
Télécharger l'image originale
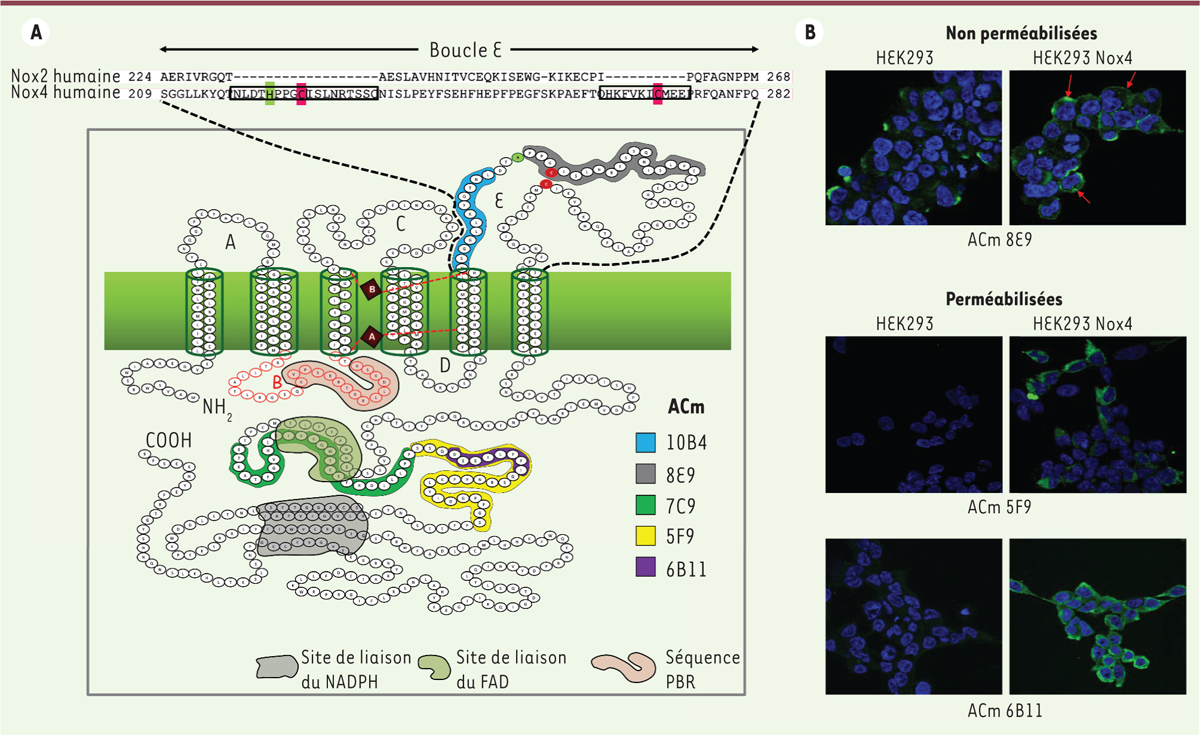
Topologie et localisation subcellulaire de Nox4. A. Schéma montrant l’organisation topologique de la séquence protéique de Nox4. Nox4 s’organise en six domaines transmembranaires (TM) avec les extrémités amino- et carboxy-terminales du coté cytosolique. Les piliers transmembranaires sont connectés par des boucles appelées A, B, C, D et E. Les boucles B et E ont été décrites comme étant essentielles à la régulation de l’activité de Nox4 [15, 33]. La boucle B permettrait un rapprochement des sites NADPH/FAD vers l’hème A, facilitant le transfert d’électrons. L’intégrité de la boucle E (insert) est nécessaire au bon fonctionnement de Nox4 et, selon l’état d’oxydation des deux cystéines C226 et C270 (en rouge), à la génération directe de H2O2 ou de O2• - par Nox4 [14]. L’histidine H222 (en vert) pourrait servir de source de protons pour accélérer la dismutation spontanée de O2•- en H2O2. Les épitopes des anticorps monoclonaux (ACm) dirigés contre Nox4 (10B4, 8E9, 7C9, 5F9 et 6B11) sont représentés sur la séquence protéique de Nox4 [11]. B. Images de microscopie confocale montrant le marquage de Nox4 au niveau de la membrane plasmique réalisé avec l’anticorps monoclonal 8E9 dans les cellules HEK293 non perméabilisées surexprimant Nox4 (images du haut), et le marquage généralisé de Nox4 réalisé avec les anticorps monoclonaux 5F9 et 6B11 dans ces mêmes cellules perméabilisées (images du bas) [11].
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




