Figure 1.
Télécharger l'image originale
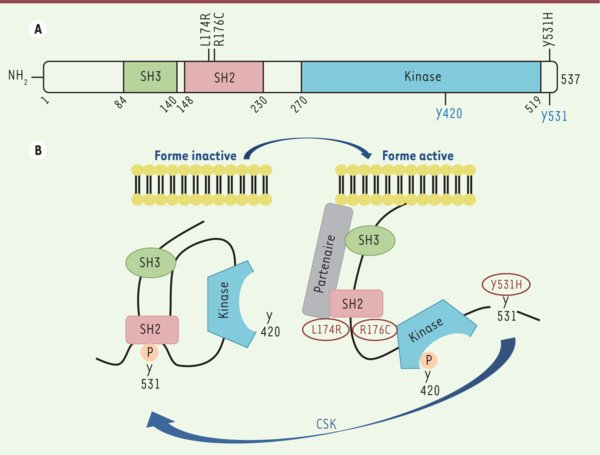
Protéine FYN. A. Structure protéique de FYN montrant les domaines identifiés et la localisation des mutations observées dans les échantillons de PTCL. B. Régulation de l’activité de la SRC kinase FYN. À l’état inactif, la tyrosine 531 située à l’extrémité carboxy-terminale de la protéine est phosphorylée par l’enzyme CSK, et son interaction avec le domaine SH2 maintient la protéine dans une configuration inactive. Dans l’état actif, la tyrosine 531 est déphosphorylée, et la tyrosine 420 située dans la boucle d’activation du domaine kinase est phosphorylée. Les mutants L174R, R176C et Y531H abolissent l’interaction entre le domaine SH2 et la phosphotyrosine 531, permettant une configuration ouverte et active de la protéine, qui résiste à l’action de CSK.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




