Figure 1.
Télécharger l'image originale
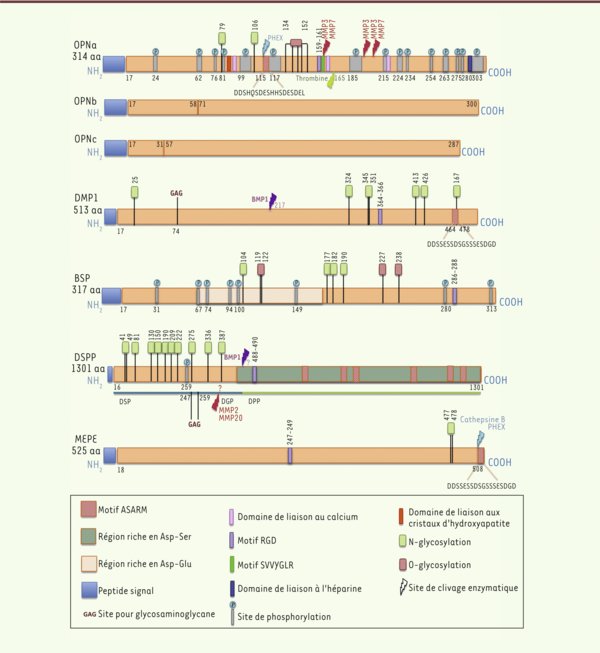
Principaux domaines structuraux et modifications post-traductionnelles potentielles des SIBLING. Cette famille comprend l’ostéopontine (OPN), la protéine matricielle de dentine (DMP1), la sialoprotéine osseuse (BSP), la sialophosphoprotéine de dentine (DSPP) et la phosphoglycoprotéine de dentine (MEPE). L’OPN possède deux isoformes obtenues par épissage alternatif : les OPNb et c. Les exons 5 et 4 sont absents dans l’OPNb et l’OPNc, respectivement. La séquence en acides aminés des protéines SIBLING est particulièrement riche en résidus de nature acide (régions riches en Asp-Ser et Asp-Glu). Ces protéines présentent plusieurs domaines communs, tels que les motifs RGD (Arg-Gly-Asp) et la séquence cryptique SVVYGLR de liaison aux intégrines. Le motif ASARM (acidic serine aspartate-rich MEPE-associated motif), les domaines de liaison à l’hydroxypatite et les sites de clivage par PHEX (phosphate-regulating endopeptidase homologue, X-linked) impliqués dans le processus de minéralisation sont indiqués. L’activité des SIBLING est régulée par des modifications post-traductionnelles, telles que la phosphorylation, la glycosylation et/ou l’addition d’un glycosaminoglycane (GAG). Enfin, le clivage des SIBLING par des enzymes, telles que la thrombine et la BMP1 (protéine morphogénétique osseuse 1), génère des fragments protéiques dotés de propriétés spécifiques. Aa : acide aminé.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




