Figure 1.
Télécharger l'image originale
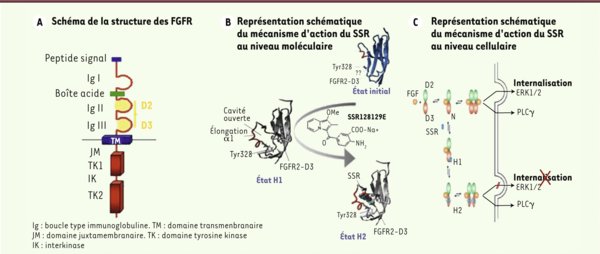
Représentation schématique du mécanisme d’action du SSR au niveau moléculaire et cellulaire. Dans la structure générale des FGFR (A) , nous avons identifié en jaune les domaines Ig II (ou D2) et Ig III (ou D3) de la partie extracellulaire du récepteur, utilisés ensuite dans les expériences d’interaction avec le SSR128129E. La représentation schématique du mécanisme d’action du SSR au niveau moléculaire (B) montre que la liaison du SSR induit, dans un premier temps, un changement de conformation (passage d’une conformation en feuillet à une conformation en hélice) (état H1). Dans un deuxième temps, la fixation du SSR dans la poche nouvellement formée permet à la protéine d’adopter une nouvelle conformation (état H2) très stable. Les conséquences de ces changements de conformation du FGFR sur la signalisation cellulaire sont illustrées en C . Ainsi, le SSR bloque la signalisation via les MAP kinases et l’internalisation du récepteur, alors qu’il n’a aucun effet sur la voie de signalisation via la phospolipase Cγ (PLCγ).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




