| Numéro |
Med Sci (Paris)
Volume 29, Numéro 3, Mars 2013
|
|
|---|---|---|
| Page(s) | 249 - 251 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2013293007 | |
| Publié en ligne | 27 mars 2013 | |
La E-sélectine, un régulateur clé de la division des cellules souches hématopoïétiques et de leur résistance à la chimiothérapie
E-selectin, a key regulator of the division of hematopoietic stem cells and their resistance to chemotherapy
Mater Research, TRI Building, 37 Kent Street, Woolloongabba, 4102, Queensland, Australie
Fonctions des cellules souches hématopoïétiques
Les cellules souches hématopoïétiques (CSH) sont à l’origine de toutes les cellules sanguines et immunitaires. Ces cellules souches doivent faire face à deux demandes contradictoires. La première est de renouveler les progéniteurs qui se divisent rapidement pour remplacer les deux millions d’érythrocytes, 15 millions de plaquettes et le demi-million de leucocytes que nous consommons par seconde. Pour ce faire, les cellules souches hématopoïétiques doivent se diviser, soit symétriquement pour générer deux cellules souches, soit asymétriquement pour donner naissance à une cellule souche et un progéniteur qui va s’engager dans une voie de différenciation. Cependant, la division cellulaire a un coût, car plus les cellules souches hématopoïétiques se divisent, plus elles perdent leur capacité d’autorenouvellement. En effet, dans plusieurs modèles de souris génétiquement modifiées, les mutations qui accélèrent la division des CSH entraînent un épuisement plus rapide du système hématopoïétique qui aboutit à une aplasie médullaire et une pancytopénie. La deuxième demande est de maintenir une réserve de cellules souches hématopoïétiques quiescentes afin d’assurer l’intégrité génétique et fonctionnelle de ce compartiment, sans lequel le système hématopoïétique ne peut plus se régénérer. En effet, chez l’homme et la souris adultes, la majorité des cellules souches hématopoïétiques ne se divisent qu’une fois toutes les 20 à 25 semaines à l’état stationnaire [1, 2], soit deux fois par an ! Quand le système hématopoïétique doit répondre à une demande accrue ou à une destruction massive de leucocytes (par exemple lors d’une infection ou au décours d’une chimiothérapie), les cellules souches sortent de leur quiescence et se divisent pour restaurer le compartiment des progéniteurs le plus rapidement possible. Puis elles quittent à nouveau le cycle cellulaire et retournent dans un état quiescent une fois le travail accompli [2]. Quels régulateurs de la moelle osseuse permettent aux cellules souches de répondre à ces différentes demandes ? De nombreuse cytokines et facteurs de croissance régulant positivement ou négativement la division des cellules souches hématopoïétiques sont connus depuis longtemps. Mais, comment certaines de ces cellules peuvent-elles rester quiescentes pendant de très longues périodes (excédant 20 semaines), alors que d’autres se divisent plus fréquemment pour régénérer les cellules sanguines ?
Niches ostéoblastique et vasculaire des cellules souches hématopoïétiques
La solution est dans l’hétérogénéité des niches. Les cellules souches hématopoïétiques ne sont pas distribuées de façon aléatoire dans la moelle osseuse, mais résident dans des niches très spécialisées [11]. Dans la moelle osseuse murine, elles sont plus abondantes près de l’endostéum, l’interface entre l’os et la moelle, et relativement plus rares au centre de la moelle osseuse [3–6]. Cette observation a conduit au concept de niche endostéale ou ostéoblastique. Cependant, de nombreuses cellules souches sont aussi en contact direct avec des cellules endothéliales formant les sinus endothéliaux [7], sortes de sacs vasculaires atones qui se remplissent et se vident de sang toutes les 2 à 3 minutes. Ces niches sont appelées niches vasculaires. Une première interprétation de cette distribution particulière est qu’il y a deux types de niches, ostéoblastiques et vasculaires, qui remplissent deux fonctions distinctes : maintenir les cellules souches quiescentes et induire leur prolifération. Cependant cette interprétation est trop simpliste, car l’endostéum est richement vascularisé par un réseau dense de sinus endothéliaux rendant la distinction entre niches endostéales et niches vasculaires arbitraire. De plus, la délétion conditionnelle du gène Kitl codant pour le ligand du récepteur à activité tyrosine kinase c-Kit dans les ostéoblastes et ostéoprogéniteurs n’a que peu d’effet sur les cellules souches hématopoïétiques. Au contraire, la délétion de ce même gène dans les cellules endothéliales et les progéniteurs mésenchymateux périvasculaires réduit fortement le nombre de cellules souches hématopoïétiques présentes dans la moelle osseuse [8]. Ces résultats suggèrent que les niches vasculaires jouent un rôle clé dans la maintenance des cellules souches.
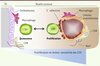 |
Figure 1. Représentation des cellules souches hématopoïétiques (CSH) quiescentes et prolifératives dans leurs niches médullaires. Les cellules souches hématopoïétiques en phase de prolifération sont dans des niches vasculaires comprenant des cellules endothéliales exprimant la E-sélectine, des cellules souches mésenchymateuses (CSM) et des macrophages spécialisés nécessaires à la niche. Les cellules souches hématopoïétiques quiescentes sont dans des niches dans lesquelles les cellules endothéliales n’expriment pas la E-sélectine ; les cellules souches n’y sont pas en contact direct avec les cellules endothéliales. L’innervation β-adrénergique contrôle l’expression de facteurs de croissance et de chimiokines maintenant les cellules souches hématopoïétiques dans leurs niches. |
La E-sélectine, un modulateur de la quiescence et de la prolifération des cellules souches hématopoïétiques
En cherchant à caractériser les signaux extracellulaires qui distinguent les niches maintenant les cellules souches hématopoïétiques quiescentes de celles qui induisent leur prolifération, nous avons identifié la E-sélectine. La E-sélectine est une protéine d’adhérence cellulaire, exprimée exclusivement par les cellules endothéliales. C’est donc une protéine exclusive de la niche vasculaire. Dans un article récemment publié dans Nature Medicine [9], nous rapportons que, chez les souris dépourvues du gène Sele codant pour la E-sélectine, la proportion de cellules souches hématopoïétiques quiescentes est plus importante et que celles-ci se divisent plus lentement. L’administration d’un inhibiteur synthétique de la E-sélectine, le GMI-1070, a le même effet que la délétion du gène Sele. Cette augmentation de la quiescence des cellules souches est aussi observée dans des transplantations croisées dans lesquelles des cellules souches hématopoïétiques sauvages sont greffées à des souris receveuses déficientes en E-sélectine. Dans les transplantations inverses (souris donneuses de cellules souches déficientes en E-sélectine, souris receveuses sauvages), les cellules souches hématopoïétiques se divisent à une vitesse normale. Ces résultats suggèrent que c’est la perte de la E-sélectine dans le stroma médullaire, et non pas dans les cellules souches hématopoïétiques, qui est responsable de cet effet. La E sélectine n’agit pas sur les cellules souches via ses récepteurs classiques - présents sur les macrophages et les neutrophiles -, comme CD162 (P-selectin glycoprotein ligand-1 ou PSGL-1) ou CD44, mais plutôt via des glycosphingolipides membranaires et la protéine ESL-1 (E-selectin ligand-1).
Les inhibiteurs de la E-sélectine pour combattre la cytotoxicité des chimiothérapies
Du fait de la plus grande proportion de cellules souches quiescentes qu’elle entraîne, la délétion de Sele ou l’administration de GMI-1070 augmente la survie des cellules souches et des souris, et diminue la période de cytopénie après administration d’une chimiothérapie intensive ou d’une forte dose de radiations (8 Gy). Le fait que seulement 10 à 20 % des cellules endothéliales médullaires expriment la E-sélectine [9] peut expliquer l’hétérogénéité des niches vasculaires, car seules les niches comprenant des cellules exprimant la E-sélectine pourraient stimuler la prolifération des cellules souches. De plus, les inhibiteurs spécifiques de la E-sélectine, comme le GMI-1070, pourraient avoir un intérêt thérapeutique pour protéger les cellules souches durant des traitements de chimiothérapie intensifs [9, 10]. En effet, les chimiothérapies répétées peuvent épuiser la réserve de cellules souches, en tuant celles qui se divisent pour régénérer les progéniteurs détruits par le traitement, ce qui résulte en un épuisement hématopoïétique avec aplasie médullaire persistante voire fatale. Le risque infectieux durant la période de neutropénie qui suit la chimiothérapie est lui aussi non négligeable. Plus cette période d’immunodéficience est longue, plus le patient court le risque d’une infection fatale, que son système immunitaire temporairement détruit ne peut combattre. En préservant la quiescence des cellules souches hématopoïétiques, ces inhibiteurs peuvent protéger ces dernières contre la cytotoxicité des chimiothérapies qui tuent sans distinction les cellules malignes et les cellules saines en division. Ceci permettrait de réduire le risque d’aplasie médullaire induit par la chimiothérapie, et de réduire la durée de la neutropénie pendant laquelle le patient court un risque élevé de contracter une infection fatale.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Catlin SN, Busque L, Gale RE, et al. The replication rate of human hematopoietic stem cells in vivo. Blood 2011 ; 117 : 4460–4466. [CrossRef] [PubMed] [Google Scholar]
- Wilson A, Laurenti E, Oser G, et al. Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair. Cell 2008 ; 135 : 1118–1129. [CrossRef] [PubMed] [Google Scholar]
- Arai F, Hirao A, Ohmura M, et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell 2004 ; 118 : 149–161. [CrossRef] [PubMed] [Google Scholar]
- Grassinger J, Haylock DN, Williams B, et al. Phenotypically identical hemopoietic stem cells isolated from different regions of bone marrow have different biologic potential. Blood 2010 ; 116 : 3185–3196. [CrossRef] [PubMed] [Google Scholar]
- Lo Celso C, Fleming HE, Wu JW, et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature 2009 ; 457 : 92–97. [CrossRef] [PubMed] [Google Scholar]
- Xie Y, Yin T, Wiegraebe W, et al. Detection of functional haematopoietic stem cell niche using real-time imaging. Nature 2009 ; 457 : 97–101. [CrossRef] [PubMed] [Google Scholar]
- Kiel MJ, Yilmaz OH, Iwashita T, et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell 2005 ; 121 : 1109–1121. [CrossRef] [PubMed] [Google Scholar]
- Ding L, Saunders TL, Enikolopov G, Morrison SJ. Endothelial and perivascular cells maintain haematopoietic stem cells. Nature 2012 ; 481 : 457–462. [CrossRef] [PubMed] [Google Scholar]
- Winkler IG, Barbier V, Nowlan B, et al. Vascular niche E-selectin regulates hematopoietic stem cell dormancy, self renewal and chemoresistance. Nat Med 2012 ; 18 : 1651–1657. [CrossRef] [PubMed] [Google Scholar]
- Baas T. Multitasking E selectin. SciBX 2012 ; doi: 10.1038/scibx.2012.1197. [Google Scholar]
- Lataillade JJ, Brunet de la Grange P, Uzan G, Le Bousse-Kerdilès MC. Les cellules souches ont-elles l’âge de leur niche ? Med Sci (Paris) 2010 ; 26 : 582–585. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2013 médecine/sciences – Inserm / SRMS
Liste des figures
 |
Figure 1. Représentation des cellules souches hématopoïétiques (CSH) quiescentes et prolifératives dans leurs niches médullaires. Les cellules souches hématopoïétiques en phase de prolifération sont dans des niches vasculaires comprenant des cellules endothéliales exprimant la E-sélectine, des cellules souches mésenchymateuses (CSM) et des macrophages spécialisés nécessaires à la niche. Les cellules souches hématopoïétiques quiescentes sont dans des niches dans lesquelles les cellules endothéliales n’expriment pas la E-sélectine ; les cellules souches n’y sont pas en contact direct avec les cellules endothéliales. L’innervation β-adrénergique contrôle l’expression de facteurs de croissance et de chimiokines maintenant les cellules souches hématopoïétiques dans leurs niches. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




