| Numéro |
Med Sci (Paris)
Volume 26, Numéro 12, Décembre 2010
|
|
|---|---|---|
| Page(s) | 1030 - 1032 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/201026121030 | |
| Publié en ligne | 15 décembre 2010 | |
La transition mésenchymato-épithéliale, passage obligatoire pour la reprogrammation de fibroblastes en iPSC
Mesenchymal-to-epithelial transition: a necessary initial step towards reprogrammation of fibroblasts
Center for Systems Biology, Samuel Lunenfeld Research Institute, Mount Sinai Hospital, Toronto, Canada
Room 1078, 600 University avenue, M5G1X5 Toronto, Canada
Une des limites de la médecine régénérative est la difficulté d’obtenir en nombre suffisant des cellules différenciées qui pourraient remplacer les cellules d’un tissu défectueux. Les cellules souches pluripotentes, par leur capacité à se développer en tout type cellulaire et à proliférer indéfiniment in vitro, pourraient répondre à cet impératif. Initialement isolées chez l’homme à partir d’embryons surnuméraires issus de fécondations in vitro, les cellules souches embryonnaires (ESC, embryonic stem cells) posent cependant plusieurs problèmes, notamment éthiques et de tolérance immunologique dans une perspective thérapeutique.
Récemment, plusieurs méthodes permettant de reprogrammer des cellules adultes différenciées en cellules pluripotentes ont vu le jour. La première est le transfert d’un noyau somatique dans un ovule, méthode qui a abouti à la naissance de Dolly. La deuxième est la fusion d’une cellule somatique et d’une cellule souche embryonnaire : dans la cellule hybride, le noyau de la cellule somatique est reprogrammé par l’environnement embryonnaire pluripotent, qui est dominant, et il prend les caractéristiques d’un noyau de ESC. Les connaissances acquises grâce à ces méthodes et grâce à l’étude des ESC ont permis de mettre au point une troisième technique en 2006. Celle-ci consiste à surexprimer des facteurs de transcription - Oct4, Klf4, c-Myc et Sox2 (OKMS) - dans une cellule somatique, ce qui entraîne la reprogrammation du noyau et l’acquisition par cette cellule somatique de caractéristiques de cellules souches pluripotentes : on parle de cellule souche pluripotente induite (iPSC) [1, 2].
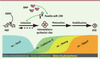 |
Figure 1. La reprogrammation de fibroblastes en iPSC se déroule en 3 phases. La phase d’initiation se caractérise par une transition mésenchymo-épithéliale (MET), sans laquelle les fibroblastes sont incapables d’être reprogrammés. Durant la MET, les marqueurs mésenchymateux (ex. : Snail) sont perdus au profit de marqueurs épithéliaux (ex. : Cadhérine-E). Ceci est régulé par la voie de signalisation BMP et la famille de micro-ARN miR-200. Après la phase d’initiation, les marqueurs de pluripotence sont exprimés, définissant les phases de maturation et de stabilisation. Dppa4 : developmental pluripotency-associated 4. |
Depuis cette découverte, les méthodes de production se sont améliorées et des critères précis de pluripotence ont été définis. Néanmoins, les mécanismes contrôlant le processus de reprogrammation lui-même n’ont pas pu être appro-fondis à cause de la très faible efficacité du processus de reprogrammation.
Transition mésenchymateuse-épithéliale : une étape nécessaire
L’établissement de modèles murins dits « secondaires » a permis de mieux appréhender les mécanismes de la reprogrammation des iPSC. Les systèmes secondaires sont obtenus par reprogrammation de cellules somatiques primaires avec des transgènes inductibles, puis différenciation des iPSC ainsi obtenues, in vitro, ou in vivo, par agrégation dans une morula et création de souris chimères à partir desquelles on peut isoler des fibroblastes (MEF, murine embryo fibroblasts) dits secondaires. En déclenchant l’expression des transgènes inductibles dans ces cellules différenciées secondaires, on peut y induire une reprogrammation et obtenir des iPSC dites secondaires. En collaboration avec le laboratoire d’Andras Nagy, nous avons mis à profit le système secondaire que ces auteurs avaient établi et qui permet l’expression d’OKMS sous la dépendance d’un promoteur Tet-ON activable par la doxycycline (Dox) [3], pour étudier l’évolution du profil d’expression génique lors de l’induction de la reprogrammation de fibroblastes embryonnaires murins (MEF) [4]. Cela nous a permis d’identifier plusieurs phases se distinguant par des signatures moléculaires spécifiques lors du processus de reprogrammation. La première phase se caractérise par une transition mésenchymo-épithéliale (MET), la deuxième par l’apparition de marqueurs précoces de la pluripotence, et la troisième par l’arrêt de l’expression des transgènes et l’apparition de marqueurs tardifs de la pluripotence (Figure 1).
Nous avons ensuite couplé cette approche descriptive des changements moléculaires qui sont observés lors de la reprogrammation avec un criblage fonctionnel. Nous avons transfecté une banque de siARN dans des MEF secondaires, juste avant l’ajout de Dox, et mesuré l’effet de chaque siARN sur la reprogrammation. Nous avons obtenu une liste de facteurs, dont l’inhibition de l’expression augmente ou diminue l’efficacité de la reprogrammation observée 5 jours plus tard par l’analyse morphologique des colonies et un marquage révélant la phosphatase alcaline, un marqueur précoce de reprogrammation. En croisant cette liste avec celle des gènes dont l’expression est soumise à une forte régulation au cours des premiers jours de la reprogrammation, nous avons identifié deux événements importants : (1) l’acquisition d’une signature épithéliale très intense (par exemple gain d’expression de la E-cadhérine, de Epcam [epithelial cell adhesion molecule], Ocln [occludine], Crb3 [de la familles de protéines crumbs]) parallèlement à la perte de la signature mésenchymateuse des MEF (perte de Snail, Slug, Zeb1/2, Thy1, N-cadhérine) ; (2) la voie de signalisation BMP (bone morphogenetic protein) est nécessaire à cette transition MET, première étape du processus de reprogrammation des MEF [4].
Nous avons confirmé l’existence d’une MET au cours de la reprogrammation. Une analyse microscopique a démontré qu’après 5 jours de traitement par Dox, qui induit l’expression des transgènes nécessaires à la reprogrammation, le cytosquelette d’actine n’est plus organisé en fibres de stress comme dans les fibroblastes, mais il est localisé dans les zones corticales. De plus, les cellules en cours de reprogrammation ont déjà établi un nouveau type de jonctions adhérentes de type épithélial (faites de E-cadhérine), similaires à celles qui sont observées dans les cellules souches pluripotentes. Une confirmation du rôle crucial de cette MET pour la reprogrammation des fibroblastes est apportée par la surexpression de protéines mésenchymateuses (ex. Snail) ou l’inhibition de l’expression de protéines épithéliales (ex. E-cadhérine) : dans les deux cas, la reprogrammation est fortement inhibée [4, 5]. Cette transition dépend clairement de la présence de BMP : l’absence de signalisation BMP empêche la reprogrammation d’avoir lieu. Une des cibles des BMP impliquée dans la MET est le cluster de microARN miR-200. La signalisation BMP induit l’expression de ces miARN qui, à leur tour, ciblent des facteurs de transcription mésenchymateux, comme Snail ou Zeb, et inhibent leur expression.
Un autre groupe a également identifié la MET comme une première étape cruciale lors de la reprogrammation en utilisant une autre approche [5]. De plus, la traduction fonctionnelle dans la cellule des modifications que nous avons décrites au niveau moléculaire a été démontrée par microscopie en temps réel, prouvant que, au cours de leur reprogrammation, les MEF effectuent réellement une transition MET [6].
Ces résultats, obtenus avec des modèles murins, sont probablement extrapolables chez l’homme. En effet, Wang et al. ont montré qu’un échec de la reprogrammation de fibroblastes est attribuable à un défaut d’accomplissement d’une MET [7].
Implications
Nos résultats permettent de proposer une explication à une observation faite en 2008 par Maherali et al. qui démontraient que les cellules épithéliales semblaient plus faciles à reprogrammer [8]. Ces cellules n’auraient pas besoin de passer par une MET. Cela apporte également une lumière nouvelle sur l’importance des jonctions intercellulaires pour la régulation de la pluripotence.
Ces résultats ont donc une implication directe sur le choix du type de cellules utilisées pour établir des iPSC. En effet, sélectionner des cellules épithéliales serait plus adapté, ces cellules ayant déjà les caractéristiques épithéliales similaires à celles de cellules souches pluripotentes, ce qui pourrait expliquer la cinétique plus rapide du processus de reprogrammation [5].
Si l’on souhaite reprogrammer des cellules mésenchymateuses en iPSC, une première étape de MET est indispensable, et nos résultats suggèrent que cette transition peut être facilitée par l’ajout de molécules favorisant la MET lors des premiers jours de reprogrammation : il a été proposé que les inhibiteurs du récepteur du TGFβ (transforming growth factor β) puissent jouer ce rôle [9, 10].
Nos résultats soulignent tout l’intérêt d’un décryptage précis des étapes du processus de reprogrammation, une meilleure connaissance des mécanismes moléculaires étant le garant d’une amélioration de l’efficacité du processus mais aussi de la fiabilité des iPSC.
Conflit d’intérêts
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Références
- Yamanaka S, Blau HM. Nuclear reprogramming to a pluripotent state by three approaches. Nature 2010 ; 465 : 704-12. [Google Scholar]
- Coulombel L. Reprogrammation nucléaire d’une cellule différenciée : on efface tout et on recommence. Med Sci (Paris) 2007 ; 23 : 667-70. [Google Scholar]
- Woltjen K, Michael IP, Mohseni P, et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature 2009 ; 458 : 766-70. [Google Scholar]
- Samavarchi-Tehrani P, Golipour A, David L, et al. Functional genomics reveals a bmp-driven mesenchymal-to-epithelial transition in the initiation of somatic cell reprogramming. Cell Stem Cell 2010 ; 7 : 64-77. [Google Scholar]
- Li R, Liang J, Ni S, et al. A mesenchymal-to-epithelial transition initiates and is required for the nuclear reprogramming of mouse fibroblasts. Cell Stem Cell 2010 ; 7 : 51-63. [Google Scholar]
- Smith ZD, Nachman I, Regev A, Meissner A. Dynamic single-cell imaging of direct reprogramming reveals an early specifying event. Nat Biotechnol 2010 ; 28 : 521-6 [Google Scholar]
- Wang Y, Mah N, Prigione A, et al. A transcriptional roadmap to the induction of pluripotency in somatic cells. Stem Cell Rev 2010 ; 6 : 282-96. [Google Scholar]
- Maherali N, Ahfeldt T, Rigamonti A, et al. A high-efficiency system for the generation and study of human induced pluripotent stem cells. Cell Stem Cell 2008 ; 3 : 340-5. [Google Scholar]
- Ichida JK, Blanchard J, Lam K, et al. A small-molecule inhibitor of tgf-Beta signaling replaces sox2 in reprogramming by inducing nanog. Cell Stem Cell 2009 ; 5 : 491-503. [Google Scholar]
- Li W, Wei W, Zhu S, et al. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors. Cell Stem Cell 2009 ; 4 : 16-9. [Google Scholar]
© 2010 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. La reprogrammation de fibroblastes en iPSC se déroule en 3 phases. La phase d’initiation se caractérise par une transition mésenchymo-épithéliale (MET), sans laquelle les fibroblastes sont incapables d’être reprogrammés. Durant la MET, les marqueurs mésenchymateux (ex. : Snail) sont perdus au profit de marqueurs épithéliaux (ex. : Cadhérine-E). Ceci est régulé par la voie de signalisation BMP et la famille de micro-ARN miR-200. Après la phase d’initiation, les marqueurs de pluripotence sont exprimés, définissant les phases de maturation et de stabilisation. Dppa4 : developmental pluripotency-associated 4. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




