Figure 1.
Télécharger l'image originale
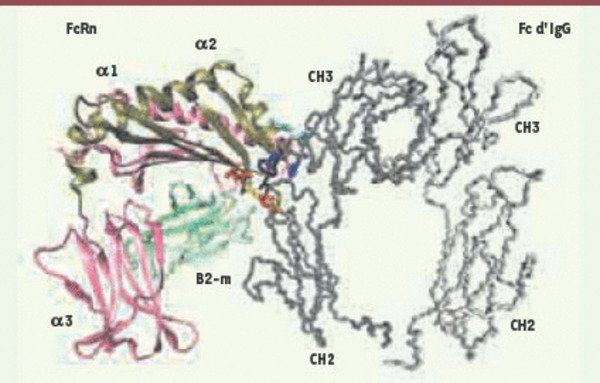
Représentation tridimensionnelle de l’interaction entre FcRn et IgG. Le FcRn est un hétérodimère composé de la β2-microglobuline (β2-m en vert) associée de façon non covalente à une chaîne lourde α transmembranaire (45 kDa) repliée en trois domaines extracellulaires : α1 (rose), α2 (bronze) et α3 (rose) seuls ici représentés. Bien que le FcRn soit apparenté aux molécules de classe I du CMH, la cavité localisée entre les domaines α1 et α2 est trop étroite pour accueillir un peptide et exercer une fonction de présentation d’antigène. Le site de fixation des IgG sur FcRn est différent de celui de l’albumine et la fixation des IgG n’influence pas celle de l’albumine [7]. Le FcRn se lie au Fc de l’IgG (gris) à l’interface entre les domaines constants CH2 et CH3, c’est-à-dire un site distinct de celui impliqué dans la liaison au C1q et aux FcγR. L’interaction est centrée sur des résidus hydrophobes associant le Trp133 du FcRn et l’Ile253 du Fc (résidus noirs), renforcée par des ponts salins impliquant sur FcRn Glu117, Glu118, Asp132 et sur Fc His310, Gln311 et His435 respectivement [5]. Les acides aminés impliqués dans ces liaisons sont respectivement figurés en jaune, rouge, bleu et cyan. La figure a été obtenue à partir du cocristal FcRn-Fc d’IgG de rat (protein data bank (PDB) 1frt). La portion Fc du cocristal a été remplacée par son équivalent humain (PDB 1e4k) en superposant les deux Fc afin de donner à la portion humaine une bonne orientation vis-à-vis du FcRn.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




