Figure 1.
Télécharger l'image originale
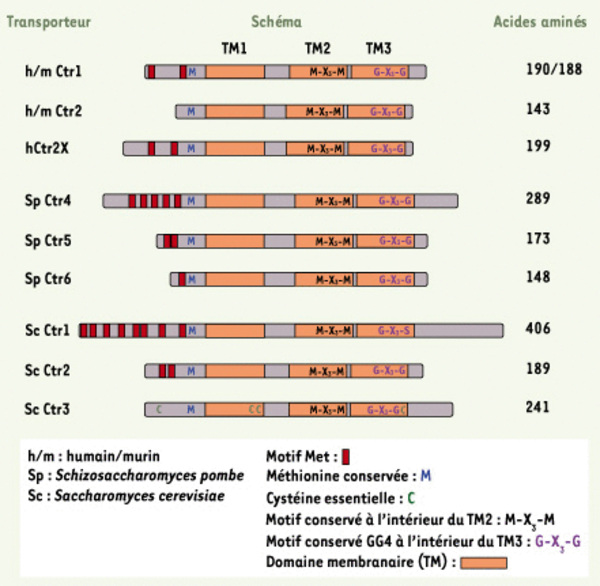
Membres de la famille des transporteurs Ctrs. Les transporteurs de la famille Ctr possèdent trois domaines transmembranaires, nommés TM1, TM2 et TM3 (orange). La région amino-terminale extracellulaire des Ctrs est généralement riche en résidus méthionines. Ces AA forment les motifs Met (MxxM et/ou MxM) (rouge) qui sont reconnus pour leur potentiel à capter le cuivre extracellulaire. Tous les Ctrs illustrés ci-contre contiennent des motifs Met, sauf le transporteur humain/murin Ctr2 et celui nommé Ctr3 chez S. cerevisiae. Ctr3 est une protéine riche en résidus cystéines. Sur les onze cystéines que comporte le Ctr3, la mutation de quatre d’entre elles (C) (vert) altère sa fonction de transport du cuivre [27]. La majorité des transporteurs Ctrs répertoriés jusqu’à présent, compte un résidu méthionine (M) (bleu) situé à environ vingt AA en amont du TM1. Ce résidu méthionine pourrait jouer un rôle important dans la coordination du cuivre près de la membrane plasmique, soit l’étape précédant le passage du cuivre à travers la membrane. Les transporteurs Ctrs présentent également une séquence MxxxM (noir) à l’intérieur du TM2. Il semble que le cuivre soit coordonné par ces AA durant le processus de transport à travers la membrane. Il existe un motif composé de deux résidus glycines espacés de trois résidus (GxxxG) (mauve) à la hauteur du TM3. Ce motif, nommé GG4, est reconnu pour stabiliser l’interaction hélice-hélice à l’intérieur de la bicouche lipidique composant les membranes et permettre la multimérisation des protéines membranaires [28].
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




