Figure 1.
Télécharger l'image originale
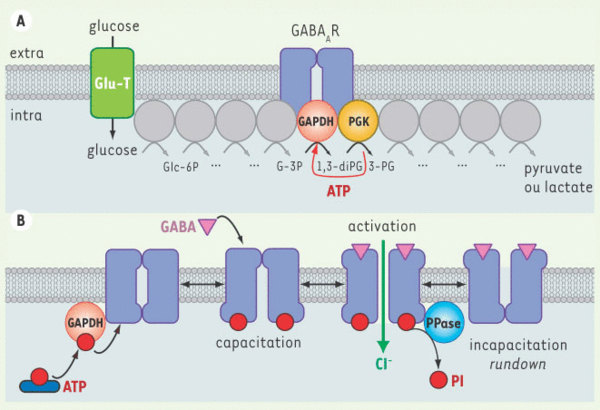
Modulation directe de l’inhibition GABAergique par la glycolyse. Le maintien de l’état fonctionnel du GABAAR est assuré par une kinase associée au récepteur, que nous avons identifiée comme la glycéraldéhyde-3P déshydrogénase (GAPDH), une enzyme de la glycolyse. Elle y joue successivement deux rôles. A. Rôle glycolytique de la GAPDH. Dès que le glucose extracellulaire est transporté dans le neurone, ce glucide entre immédiatement dans la voie glycolytique dont les enzymes peuvent s’associer en chaîne pour plus d’efficacité. Une production d’ATP glycolytique s’effectue à la membrane à l’étape catalysée par la phosphoglycérate kinase (PGK). Cet ATP sera rétrocédé à la GAPDH qui va alors pouvoir jouer son rôle supplémentaire de kinase du GABAAR. B. Rôle de kinase endogène de la GAPDH. La GAPDH utilise l’ATP glycolytique pour s’autophosphoryler. La phospho-enzyme transfère ensuite deux phosphates à la boucle intracytoplasmique de la sous-unité α1 du GABAAR sur une thréonine et une sérine. Cela entraîne la capacitation du récepteur : le canal associé pourra alors - et alors seulement - s’ouvrir lors de la liaison du GABA sur son site extracellulaire. Enfin, une phosphatase membranaire atypique (PPase) contrecarre ce mécanisme en déphosphorylant le récepteur, ce qui conduit à une incapacitation et au rundown de la réponse GABAergique. Le maintien de l’inhibition rapide dépend donc étroitement de la consommation de glucose. Glu-T : transporteur du glucose ; Glc-6P : glucose-6P ; G-3P : glycéraldéhyde-3P, 1,3-diPG : 1,3-diphosphoglycérate ; 3-PG : 3-phosphoglycérate.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




