Figure 5.
Télécharger l'image originale
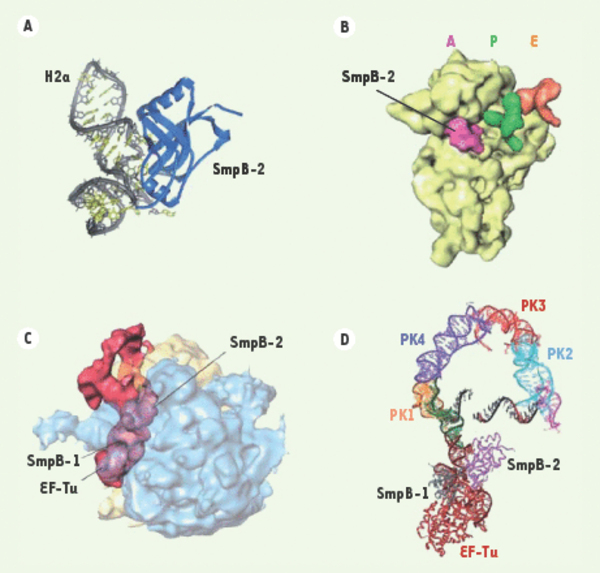
A. Complexe entre la protéine SmpB et le domaine pseudo-ARNt de l’ARNtm résolu par cristallographie aux rayons X. La protéine SmpB se lie à la partie coudée de la portion ARNt de l’ARNtm. L’une des deux faces basiques de la protéine (du côté de son extrémité amino-terminale) fait face à l’ARN tandis que l’autre (proche de l’extrémité carboxy-terminale) reste disponible pour interagir avec d’autres portions de l’ARNtm ou avec les ARN ribosomiques [18]. B. Localisation de l’une des deux protéines SmpB au sein de la petite sous-unité 30S d’un ribosome bloqué en cours de traduction par cryo-microscopie électronique. La protéine SmpB-2 est visualisée en rose dans le site de décodage. Les ARNt placés dans les sites P et E sont en vert et orange respectivement. La grande sous-unité a été volontairement omise par souci de clarté [13]. C. Vue tridimensionnelle d’un ribosome bloqué lié au complexe quaternaire ARNtm/2SmpB/EF-Tu•GTP obtenue par cryo-microscopie électronique. La densité du ribosome est représentée sous forme semi-transparente. Le complexe quaternaire est en rouge. SmpB1 interagit avec la grande sous-unité ribosomique ; SmpB-2 avec le centre de décodage de la petite sous-unité [15]. D. Modèle atomique du complexe représenté en C. Les protéines SmpB-1 et SmpB-2, respectivement colorées en gris et violet, sont placées de part et d’autre de la portion ARNt de l’ARNtm. La protéine EF-Tu (rouge) se situe dans la même position que lors de la traduction canonique tandis que les pseudo-nœuds forment un grand arc qui place le cadre ouvert de lecture de l’ARNtm à proximité du centre de décodage du ribosome [15] (Figures 5B et 5C et D reproduites avec la permission de The American society for biochemistry and molecular biology et The National Academy of Sciences, USA, respectivement).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




