| Numéro |
Med Sci (Paris)
Volume 23, Mars 2007
Protéomique clinique en oncologie
|
|
|---|---|---|
| Page(s) | 27 - 30 | |
| Section | M/S revues | |
| DOI | https://doi.org/10.1051/medsci/2007231s27 | |
| Publié en ligne | 15 mars 2007 | |
Protéomique fonctionnelle en oncologie
Comprendre plus que décrire
Functional proteomics in oncology: to understand more than to describe
ERI-8 Inserm (JE-2488), Signalisation des facteurs de croissance dans le cancer du sein. Protéomique fonctionnelle, Équipe labellisée Ligue Contre le Cancer, IFR-147, Université des Sciences et Technologies de Lille, 59650 Villeneuve d’Ascq, France
*
hubert.hondermarck@univ-lille1.fr
Comme les autres approches -omiques, la protéomique est un moyen de description globale du contenu moléculaire, ici les protéines, utilisé pour la mise en évidence de nouveaux marqueurs d’états pathologiques comme le cancer. La protéomique est également un outil puissant pour le décryptage des mécanismes moléculaires à l’origine des pathologies. Dans le cancer, la dérégulation de la croissance et de la migration des cellules correspond à des perturbations des voies de signalisation et les multiples interactions protéine-protéine et protéine-acide nucléiques à la base du phénotype cellulaire cancéreux ne sont que très partiellement connus. Grâce à ses possibilités de séparation, d’identification des protéines et d’étude des modifications post-traductionnelles, la protéomique donne accès à la compréhension de mécanismes post-génétiques de la cancérisation et permet de mettre en évidence de nouvelles cibles thérapeutiques.
Abstract
Like other -omics, proteomics is traditionally understood as a methodthat allows a global description of molecular content (here proteins)of a biological sample, used to identify new biomarkers in diseasessuch as cancers. Proteomics is also a powerful tool to identify themolecular mechanisms of diseases. In cancer, deregulation of cellgrowth and migration is related to alterations in cell signalling andthe numerous alterations in protein-protein and protein-nucleic acidinteractions that account for the malignant phenotype are only partlyunderstood. Based on its capacity to separate and identify proteins,including those with post-translational modifications, proteomicsprovides new ways to understand post-genomic events that contributeto transformation and to identify new therapeutic targets.
© 2007 médecine/sciences - Inserm / SRMS
Le protéome, nouveau champ d’exploration en oncologie
Il y a encore de cela quelques années, il était difficile de défendre l’idée que l’étude de l’ensemble des protéines (protéome) de cellules tumorales, de biopsies ou de fluides biologiques était une façon pertinente d’identifier de nouveaux marqueurs ou de nouvelles cibles thérapeutiques pour le cancer. En effet, la génétique moléculaire était dominante et l’analyse des acides nucléiques était censée permettre à elle seule d’établir les causes des maladies (mutations) qui allaient pouvoir être corrigées par thérapie génique. Chaque période scientifique a ses mythes et, avec la fin du séquençage du génome humain, il est apparu que la seule connaissance du matériel génétique ne permettait ni la compréhension absolue ni le traitement des mécanismes moléculaires menant aux pathologies comme le cancer.
Aujourd’hui, il est devenu nécessaire de dire que les protéines sont en fait les effecteurs fonctionnels des gènes et que la fonction des gènes ne peut se comprendre qu’à travers l’étude des protéines correspondantes. Le protéome est ainsi devenu un centre d’intérêt primordial pour la recherche de marqueurs pathologiques et de cibles thérapeutiques [1]. Dans le même temps, les développements technologiques en protéomique ces dernières années, notamment avec la spectrométrie de masse, la chimie et la bio-informatique, permettent l’exploration fine du protéome des cellules cancéreuses. Cependant, la difficulté des expérimentations de protéomique reste liée à la complexité cellulaire et moléculaire des systèmes oncologiques, et le cancer du sein constitue, à cet égard, un cas d’école [2, 3].
Du différentiel au fonctionnel : l’exemple du cancer du sein
L’idée est simple que de comparer des échantillons normaux et cancéreux pour définir des spécificités moléculaires propres à la cancérisation. Dans le modèle du sein, l’exploration du contenu protéique avait commencé bien avant la protéomique et des marqueurs ont été identifiés par électrophorèse 2D (comme certaines cytokératines ou tropomyosines dès les années 1980). La célèbre cathepsine D, protéine marqueur des cancers du sein hormono-dépendants,découverte par l’équipe de Jean Rochefort à Montpellier (France), fait partie de cette série de marqueurs initialement identifiés. Cependant, il faut reconnaître que, depuis lors, peu de nouvelles protéines ont été identifiées et les récepteurs des œstrogènes constituent toujours les marqueurs de référence dans le cancer du sein.
De fait, il est maintenant établi que le protéome de cellules cancéreuses ne subit qu’un nombre limité de modifications par rapport au protéome des cellules normales. Cela traduit probablement le fait que la cancérisation d’une cellule nécessite un nombre limité de modifications moléculaires. Au niveau génique, il a d’ailleurs été montré que l’on peut induire la cancérisation avec seulement quelques modifications (mutations de quelques oncogènes et gènes suppresseurs) et le même profil semble se dessiner au niveau protéique. Autre constatation, il existe une hétérogénéité, une diversité des tumeurs mammaires ainsi que de diversité des mécanismes menant à la cancérisation. Des différences en nombre limité et une variabilité d’une tumeur à l’autre, voila les difficultés principales de l’analyse différentielle.
Cependant de nouveaux marqueurs ont été identifiés plus récemment. C’est le cas notamment du chaperon moléculaire 14-3-3 sigma. Le taux de protéine 14-3-3 sigma est 10 fois moindre dans les cellules de cancer du sein que dans les cellules mammaires normales et son niveau apparaît très faible dans les biopsies de cancer du sein [4]. De façon complémentaire à l’analyse protéomique, en utilisant les méthodes de la génomique, il a été montré une hyperméthylation du gène de 14-3-3 sigma dans les cellules de cancer du sein, entraînant une perte d’expression des ARNm dans les tumeurs mammaires [5]. 14-3-3 sigma est maintenant considérée comme un marqueur précoce de la cancérisation mammaire et cette protéine suscite également de l’intérêt pour son rôle potentiel dans le contrôle du phénotype tumoral. En définitive, la mise en évidence de 14-3-3 sigma comme suppresseur de tumeur illustre la complémentarité des approches de la génomique et de la protéomique pour la mise en évidence de modifications moléculaires caractéristiques du processus de cancérisation.
Un autre exemple est constitué par le facteur de croissance NGF (nerve growth factor). Facteur neurotrophique par excellence, le NGF est bien connu pour son rôle stimulateur de la survie et de la différenciation des neurones au cours du développement du système nerveux. De façon inattendue, il a été montré que ce facteur de croissance est fortement exprimé dans les cellules de cancer du sein alors qu’il n’est pas trouvé dans les cellules épithéliales mammaires normales et son mode de signalisation autocrine (Figure 1) a déjà fait l’objet d’un certain nombre d’investigations [6–8]. Il est encore trop tôt pour savoir si 14-3-3 et le NGF seront des marqueurs d’intérêt clinique et éventuellement des cibles thérapeutiques, mais l’exemple du récepteur membranaire Erb-B2 et son utilisation en routine clinique (pour le ciblage de l’herceptine) offre une preuve de concept que les protéines de faible niveau d’expression présentent un intérêt considérable.
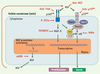 |
Figure 1. Signalisation du NGF (nerve growth factor) dans les cellules de cancer du sein. Le NGF est produit par les cellules de cancer du sein et sa sécrétion se traduit par une stimulation autocrine de la survie et de la prolifération cellulaire. Deux catégories de récepteurs sont exprimés à la surface des cellules tumorales, le récepteur à activité tyrosine kinase TrkA et le récepteur de mort p75NTR. La stimulation de TrkA se traduit par l’activation des MAP-kinases qui stimulent la prolifération alors que le récepteur p75NTR active le facteur de transcription NF-κB pour induire la survie cellulaire. Les médiateurs de l’activité de p75NTR sont les TNF-receptor associated proteins TRAF2 et TRAF6 ainsi que le TNF-receptor associated death domain (TRADD). La kinase Akt occupe une position centrale dans l’activité anti-apoptotique du NGF et son activité nécessite l’ATPase VCP (valosin containing protein). Les différentes possibilités de blocage de l’activité du NGF sont indiquées en rouge (anticorps anti-NGF ou anti-TrkA ou anti-p75NTR bloquant, inhibiteurs pharmacologiques K-252a, PD98059, dominant négatif IκBm ou interférence par l’ARN). |
La protéomique pour le décryptage des voies de signalisation
Au-delà de l’analyse différentielle, la protéomique offre également la possibilité d’explorer les interactions protéine-protéine et les réseaux de signalisation intracellulaires qui gouvernent le phénotype et plus généralement le comportement des cellules cancéreuses. Ce domaine d’activité que l’on appelle protéomique fonctionnelle est actuellement en plein essor et est d’un intérêt primordial pour l’analyse des mécanismes moléculaires de la cancérisation. Des interactions ligand-récepteurs à l’activation des cascades de signalisation et la régulation des facteurs de transcription, rien n’échappe dorénavant à l’outil protéomique dont la sensibilité et précision d’analyse ne cesse de s’améliorer.
Classiquement, l’analyse de la signalisation intracellulaire se fait par emploi d’anticorps anti-molécules de signalisation et par un jeu couplant l’immunoprécipitation au Western blot, il est possible de mettre en évidence des interactions spécifiques. La limitation majeure de ces approches traditionnelles est le caractère préconçu des investigations. Si une protéine est suspectée intervenir dans un processus, l’investigateur se procure l’anticorps correspondant pour étudier son implication. L’apport essentiel de la protéomique dans ce domaine est de permettre une approche sans a priori, dans laquelle de nouveaux partenaires non suspectés pourront être découverts.
Ces potentialités font maintenant appel à des méthodologies spécifiques de mise en évidence des interactions comme des marquages par isotopes stables dont la détection en spectrométrie de masse peut permettre de suivre l’évolution qualitative et quantitative des modifications post-traductionnelles [9, 10]. Dans le domaine du cancer du sein, le décryptage des voies de signalisation des facteurs de croissance et des hormones constitue une piste pour la mise en évidence de nouvelles cibles thérapeutiques.
Une illustration de la potentialité de ces approches est fournie par les travaux récemment réalisés avec la serine thréonine kinase Akt. Un nombre croissant de travaux indique que la kinase Akt est indispensable à la survie des cellules de cancer du sein (par exemple [11]), mais sa distribution ubiquitaire dans la plupart des tissus de l’organisme ainsi que la diversité des effets cellulaires induits par Akt limitent considérablement son intérêt comme cible thérapeutique. L’utilisation des outils de la protéomique avec l’électrophorèse pour purifier les partenaires de Akt et la spectrométrie de masse pour leur identification a permis de mettre en évidence un nouveau partenaire, la valosin-containing protein (VCP), dont l’activité semble être spécifiquement liée à l’effet anti-apoptotique de Akt.
VCP est une ATPase dont le rôle dans le contrôle de la survie cellulaire a été suspecté mais pour lequel on ne disposait de presque aucune information sur son mécanisme d’action. Les travaux réalisés par Vandermoere et al. [12, 13] montrent que VCP interagit spécifiquement avec Akt lorsque les cellules cancéreuses sont stimulées par les facteurs de croissance anti-apoptotiques. Cette interaction est dépendante de la dose et du temps et peut être observée dans les cellules vivantes. Par utilisation de la mutagenèse dirigée, trois sites de phosphorylation sur les Serine - 351, - 745 et - 747 ont été définis et l’utilisation de l’interférence par l’ARN ou d’inhibiteurs pharmacologiques permet de constater que l’activité anti-apoptotique de Akt dans les cellules de cancer du sein nécessite impérativement une interaction et activation de VCP. Ainsi VCP, qui semble spécifiquement associé aux effets de survie cellulaire de Akt pourrait constituer une cible thérapeutique moins ubiquitaire et plus spécifique.
Il est important de souligner ici que l’utilisation de la protéomique pour l’analyse de la signalisation nécessite la complémentarité avec d’autres approches de biologie cellulaire et moléculaire. Ainsi une identification en spectrométrie de masse se basant sur la reconnaissance d’une petite partie de la protéine (fragment trypsique) devra toujours être confirmée par une autre approche comme la reconnaissance par anticorps. De plus, la véracité d’une interaction devra toujours être confirmée in cellulo en microscopie confocale afin de confirmer dans la cellule ce qui est constaté en tube à essai et l’effet d’une inhibition de la proteine d’intérêt devra être étudié après inhibition de la synthèse et/ou de l’activité par ARN interférence ou emploi de dominants-négatifs. Il est également important de toujours vérifier de façon ultime l’impact sur le phénotype cellulaire (prolifération, migration, différenciation, croissance sans ancrage).
Ainsi, dans le domaine de l’analyse de la signalisation des cellules cancéreuses, la protéomique est un outil qui s’inscrit nécessairement dans une démarche plus globale et qui complémente l’arsenal technologique plus traditionnel.
De l’époque des pionniers à la constitution de programmes internationaux
Dans le cas du cancer du sein mais aussi d’autres domaines biomédicaux, la protéomique n’est maintenant plus seulement l’apanage de quelques spécialistes mais commence à être plus largement utilisée. Corrélativement, des programmes nationaux et internationaux commencent à se mettre en place. Ainsi, le programme HUPO (Human Proteome Organization, www.hupo.org) a pour vocation de stimuler et coordonner l’analyse du protéome humain et comme
HUGO a son époque il est sous-tendu par les potentialités d’applications biomédicales : la mise en évidence de marqueurs et cibles thérapeutiques. Les aspects de protéomique fonctionnelle sont évidemment inclus dans les objectifs de HUPO et c’est la SFEAP (Société Française d’Électrophorèse et d’Analyse Protéomique, http://sfeap.free.fr) qui assure le lien avec les activités développées en France.
La standardisation des procédures de collecte et d’analyse des échantillons, la définition de guides des bonnes pratiques, la centralisation bioinformatique des données et la coordination au niveau mondial sont les questions actuellement prioritaires au sein de HUPO, mais dans une deuxième phase l’étude des cancers y tiendra bien sûr une place importante. En France, le Réseau National des Génopoles (notamment avec le programme REBEP, http://rng.cnrg.fr/contents.php3?origin=rebep), l’INSERM et l’INCA réfléchissent à ces questions et une articulation avec HUPO se met en place.
Références
- Hondermarck, H. (ed) (2004) Biomedical and Pharmaceutical Applications of Proteomics, Kluwer-Springer, Dordrecht, The Netherlands.ISBN: 1-4020-23 22–7. [Google Scholar]
- Hondermarck H. Breast cancer: when proteomics challenges biological complexity. Mol Cell. Proteomics 2003; 2 : 281–91. [Google Scholar]
- Celis JE, Moreira JM, Gromova I, et al. Towards discovery-driven translational research in breast cancer. FEBS J 2005; 272 : 2–15 [Google Scholar]
- Vercoutter-Edouart AS, Lemoine J, Le Bourhis X, et al. Proteomic analysis reveals that 14-3-3 sigma is down-regulated in human breast cancer cells. Cancer Res 2001; 61 : 76–80 [Google Scholar]
- Hermeking H. The 14-3-3 cancer connection. Nat Rev Cancer 2003;3 : 931–43 [Google Scholar]
- Descamps S, Toillon RA, Adriaenssens E, et al. Nerve growth factor stimulates proliferation and survival of human breast cancer cells through two distinct signaling pathways. J Biol Chem 2001;276 : 17864–70. [Google Scholar]
- Dollé L, El-Yazidi I, Adriaenssens E, et al. Nerve growth factor overexpression and autocrine loop in breast cancer cells. Oncogene 2003; 22 : 5592–601. [Google Scholar]
- Dolle L, Adriaenssens E, El Yazidi-Belkoura I, et al. Nerve growth factor receptors and signaling in breast cancer. Curr Cancer Drug Targets 2004;4 : 463–70 [Google Scholar]
- Aebersold R, Mann M. Mass spectrometry-based proteomics. Nature 2003; 422 : 198–207. [Google Scholar]
- Jensen ON. Modification-specific proteomics: characterization of post-translational modifications by mass spectrometry. Curr Opin Chem Biol 2004; 8 : 33–41. [Google Scholar]
- Vandermoere F, El Yazidi-Belkoura I, Adriaenssens E, et al. The antiapoptotic effect of fibroblast growth factor-2 is mediated through nuclear factor-kappaB activation induced via interaction between Akt and IkappaB kinase-beta in breast cancer cells. Oncogene 2005;24 : 5482–91. [Google Scholar]
- Vandermoere F, El Yazidi-Belkoura I, Slomianny C, et al. The valosin containing protein (VCP) is a target of Akt signaling required for cell survival. J Biol Chem 2006; 281 : 14307–13. [Google Scholar]
- Vandermoere F, El-Yaridi-Belkoura I, Demont Y, et al. Proteomic exploration reveals that actin is a signaling target of the kinase Akt. Mol Cell Proteomics 2007; 6 : 114–24. [Google Scholar]
Liste des figures
 |
Figure 1. Signalisation du NGF (nerve growth factor) dans les cellules de cancer du sein. Le NGF est produit par les cellules de cancer du sein et sa sécrétion se traduit par une stimulation autocrine de la survie et de la prolifération cellulaire. Deux catégories de récepteurs sont exprimés à la surface des cellules tumorales, le récepteur à activité tyrosine kinase TrkA et le récepteur de mort p75NTR. La stimulation de TrkA se traduit par l’activation des MAP-kinases qui stimulent la prolifération alors que le récepteur p75NTR active le facteur de transcription NF-κB pour induire la survie cellulaire. Les médiateurs de l’activité de p75NTR sont les TNF-receptor associated proteins TRAF2 et TRAF6 ainsi que le TNF-receptor associated death domain (TRADD). La kinase Akt occupe une position centrale dans l’activité anti-apoptotique du NGF et son activité nécessite l’ATPase VCP (valosin containing protein). Les différentes possibilités de blocage de l’activité du NGF sont indiquées en rouge (anticorps anti-NGF ou anti-TrkA ou anti-p75NTR bloquant, inhibiteurs pharmacologiques K-252a, PD98059, dominant négatif IκBm ou interférence par l’ARN). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




